Определить, образуется ли осадок хлорида свинца (II), если к 0,05 М раствору нитрата свинца (II) добавить равный объем 0,02 М раствора хлороводородной кислоты.
Дано: с 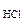 = 0,02 M с = 0,02 M с 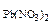 = 0,05 M V = 0,05 M V 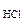 = V = V 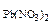 |
| Образуется ли осадок-? |
РЕШЕНИЕ:
При сливании растворов протекает следующая реакция:
Pb(NO3)2 + 2HCl= PbCl2 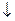 + 2HNO3
+ 2HNO3
Осадок PbCl2 образуется только в случае, если
с 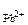 ·с
·с 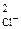 > ПР
> ПР 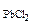 = 2·10
= 2·10 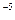 (табл.)
(табл.)
С учетом увеличения объема раствора при сливании в 2 раза:
с 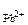 =
= 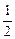 с
с 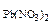 ·
· 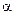 ·n
·n 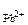 =
= 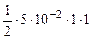 = 2,5·10-2 моль/л
= 2,5·10-2 моль/л
с 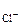 =
= 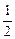 с
с 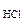 ·
·  ·n
·n 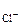 =
= 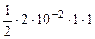 = 1·10-2 моль/л
= 1·10-2 моль/л
с 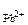 ·с
·с 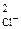 = 2,5·10
= 2,5·10 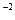 ·(1·10
·(1·10 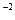 )2 = 2,5·10
)2 = 2,5·10 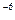
Так как 2,5·10 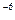 < 2·10-5 (ПР
< 2·10-5 (ПР 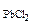 ), то осадок PbCl2 не образуется.
), то осадок PbCl2 не образуется.
Ответ: осадок PbCl2 не образуется .
3. Составить схему коррозионного ГЭ, возникающего при контакте оловянной пластинки, площадью 35 см2 с медной в растворе хлороводородной кислоты. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 70 минут в процессе коррозии выделилось 1,5 см3 газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 80 минут потеря массы корродируемого металла составила 5,6 ∙10-3 г. Плотность металла 7,3 г/см3.
РЕШЕНИЕ:
По таблице находим значения стандартных электродных потенциалов олова (II) и меди (II):
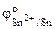 = - 0,14 В,
= - 0,14 В, 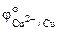 = 0,34 В.
= 0,34 В.
Так как 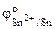 <
< 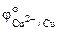 , то анодом в коррозионном ГЭ будет олово, катодом – медь.
, то анодом в коррозионном ГЭ будет олово, катодом – медь.
Составим схему коррозионного ГЭ:
А(-)Sn │ HCl │ Cu(+)K
или
А(-)Sn │ H+ │ Cu(+)K
Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии:
На A(-)Sn – 2ē = Sn2+
На К(+)2Н+ + 2ē = Н2

Sn + 2H+ = Sn2+ + H2
Sn + 2HCl = SnCl2 + H2 – суммарная реакция процесса коррозии.
а)

| Рассчитываем объемный показатель коррозии (KV) по формуле: KV =  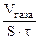 , см3/м2∙час. При расчете KV принимаем: S – площадь поверхности анода, м2; τ – время процесса коррозии, час; Vгаза – объем выделившегося газа, см3. , см3/м2∙час. При расчете KV принимаем: S – площадь поверхности анода, м2; τ – время процесса коррозии, час; Vгаза – объем выделившегося газа, см3. |
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород. Следовательно, Vгаза = 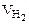 .
.
Тогда, KV = 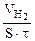 =
= 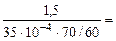 367,3 см3/м2∙час.
367,3 см3/м2∙час.
Рассчитываем весовой показатель коррозии Km по формуле:
Km = 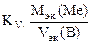 , г/м2∙час.
, г/м2∙час.
В процессе коррозии разрушению подвергается олово и выделяется водород.
Следовательно:
Мэк(Ме) = Мэк(Sn) = 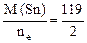 =59,5 г/моль,
=59,5 г/моль,
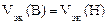 = 11200 см3/моль.
= 11200 см3/моль.
Km = 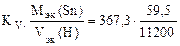 = 1,95 г/м2∙час.
= 1,95 г/м2∙час.
Ответ: KV = 367,3 см3/м2∙час.
Km = 1,95 г/м2∙час.
б)
 | Рассчитываем весовой показатель коррозии Km по формуле: Km =  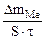 , г/м2∙час. Коррозии подвергается олово. Тогда потеря массы металла , г/м2∙час. Коррозии подвергается олово. Тогда потеря массы металла 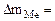 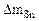 |
При расчете Km принимаем: 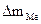 - [г]; S – [м2], τ - [час].
- [г]; S – [м2], τ - [час].
Тогда: Km = 
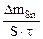 =
= 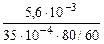 = 1,2 г/м2∙час.
= 1,2 г/м2∙час.
Рассчитываем глубинный показатель коррозии по формуле:
П = 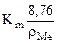 =
= 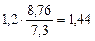 мм/год.
мм/год.
Ответ: Km = 1,2 г/м2∙час, П = 1,44 мм/год.
17. МЕТАЛЛЫ V – VI ГРУППЫ
УРОВЕНЬ А
1. Можно ли восстановить оксид хрома (III) до металла при стандартных условиях:
А) цинком;
Б) кремнием.
Ответ подтвердить расчетом 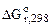 по
по 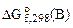 .
.
| Дано: Cr2O3; Zn; Si | РЕШЕНИЕ: а) Составляем уравнение реакции и рассчитываем стандартное изменение энергии Гиббса 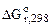 вреакции, используя I следствие из закона Гесса. Значения стандартных энергий Гиббса образования веществ вреакции, используя I следствие из закона Гесса. Значения стандартных энергий Гиббса образования веществ 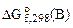 берем из таблицы cтандартных термодинамических величин. берем из таблицы cтандартных термодинамических величин. |
| Cr - ? |
Cr2O3(к) + 3Zn(к) = 2Сr(к) + 3ZnO(к) (15.1)
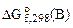 -1058,97 0 0 3(-320,7)
-1058,97 0 0 3(-320,7)
кДж/моль
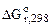 (15.1) = [
(15.1) = [ 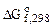 (ZnO(к)) + 2
(ZnO(к)) + 2 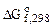 (Сr(к))] –
(Сr(к))] –
- [ 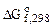 (Cr2O3(к)) + 3
(Cr2O3(к)) + 3 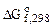 (Zn(к))] = 3(-320,7) -
(Zn(к))] = 3(-320,7) -
-(-1058,97) = 96,87 кДж
Так как 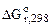 (15.1) > 0, то при стандартных условиях реакция невозможна.
(15.1) > 0, то при стандартных условиях реакция невозможна.
б) Аналогично:
2Cr2O3(к) + 3Si(к) = 4Сr(к) + 3SiО2(к) (15.2)
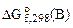 2(-1058,97) 0 0 3(-856,7)
2(-1058,97) 0 0 3(-856,7)
кДж/моль
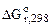 (15.2) = [3
(15.2) = [3 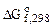 (SiO2(к)) + 4
(SiO2(к)) + 4 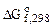 (Cr(к))] -
(Cr(к))] -
-[2 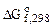 (Cr2O3(к)) + 3
(Cr2O3(к)) + 3 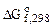 (Si(к))] = 3(-856,7) –
(Si(к))] = 3(-856,7) –
-2(-1058,97) = -452,16 кДж
Так как 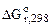 (15.2) < 0, то самопроизвольное протекание реакции при стандартных условиях возможно.
(15.2) < 0, то самопроизвольное протекание реакции при стандартных условиях возможно.
Ответ: При стандартных условиях возможно восстановление хрома из оксида хрома (III) кремнием.
2. Определить рН раствора, при котором установилось равновесие: 2CrO 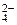 + 2H+ <=> Cr2O
+ 2H+ <=> Cr2O 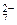 + H2O Равновесные концентрации ионов Cr2O
+ H2O Равновесные концентрации ионов Cr2O 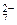 и CrO
и CrO 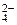 соответственно равны 4,5 моль/л и 0,001 моль/л. Константа равновесия Кс = 1,1·1018.
соответственно равны 4,5 моль/л и 0,001 моль/л. Константа равновесия Кс = 1,1·1018.
Дано: [Cr2O 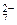 ]=4,5 моль/л [CrO ]=4,5 моль/л [CrO 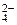 ]=0,001 моль/л Кс = 1,1·1018 ]=0,001 моль/л Кс = 1,1·1018 |
| рН - ? |
РЕШЕНИЕ:
2CrO 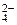 + 2H+ <=> Cr2O
+ 2H+ <=> Cr2O 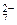 + H2O
+ H2O
рН = -lg[H+]
Kc = 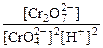
[H+] = 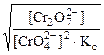 = =
= = 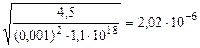 моль/л
моль/л
рН = -lg2,02·10-6 = 5,7
Ответ: рН = 5,7
3. Шестивалентный элемент взаимодействуя с кислородом при н.у., образует оксид, содержащий 20,71% масс. кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.

| РЕШЕНИЕ: По закону эквивалентов: nэк(О2) = nэк(Э)  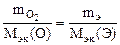 Мэк(О) = 8 г/моль Мэк(О) = 8 г/моль |
Мэк(Э) = 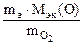
mокс = mэ + 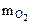
mэ = 100 - 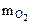 = 100 – 20,71 = 79,29 г.
= 100 – 20,71 = 79,29 г.
Мэк(Э) = 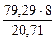 = 30,63 г/моль
= 30,63 г/моль
Мэк(Э) = 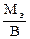 , где В – валентность элемента.
, где В – валентность элемента.
Мэ = Мэк(Э)∙В = 30,63∙6 = 183,77 г/моль, что соответствует молекулярной массе атома вольфрама .
Ответ: Мэк(Э) = 30,63 г/моль; элемент – W.
УРОВЕНЬ В
1. Уравнять реакцию, указать окислитель и восстановитель:
Cr(NO3)3 + Br2 + KOH → K2CrO4 + KBr + KNO3 + H2O Определить, какой объем 2 н раствора нитрата хрома (III) расходуется на взаимодействие с бромом массой 4,3 г.
Дано: m 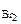 = 4,3 г сэк(Cr(NO3)3)= 2 моль/л = 4,3 г сэк(Cr(NO3)3)= 2 моль/л |
| Vр-ра(Сr(NO3)3 - ? |
РЕШЕНИЕ:
Cr+3(NO3)3 + Br20 + KOH → → K2Cr+6O4 + KBr-1 + KNO3 + H2O
НОК ДМ

 восст-ль Cr+3 - 3e = Cr+6 2
восст-ль Cr+3 - 3e = Cr+6 2
окисл-ль Br20 + 2e = 2Br- 3
 3Br2 + 2Cr+3 = 6Br- + 2Cr+6
3Br2 + 2Cr+3 = 6Br- + 2Cr+6
Переносим найденные коэффициенты в молекулярное уравнение. Уравниваем число ионов 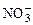 →6
→6 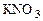 . Считаем число ионов К+ в продуктах реакции и определяем коэффициент перед КОН → 16КОН. Уравниваем число атомов Н и О → 8Н2О.
. Считаем число ионов К+ в продуктах реакции и определяем коэффициент перед КОН → 16КОН. Уравниваем число атомов Н и О → 8Н2О.
2Cr(NO3)3 +3Br2 +16KOH = 2K2CrO4 + 6KBr + 6KNO3 + 8H2O
По закону эквивалентов:
nэк(Cr(NO3)3) = nэк(Br2)
Vр-ра(Сr(NO3)3 · сэк(Cr(NO3)3) = 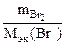
Mэк(Br) = 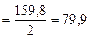 г/моль
г/моль
Vр-ра (Сr(NO3)3 · 2 = 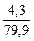 ; Vр-ра (Сr(NO3)3 = 0,0269 л = 26,9 см3
; Vр-ра (Сr(NO3)3 = 0,0269 л = 26,9 см3
Ответ: Vр-ра (Сr(NO3)3 = 26,9 см3
2. Найти массы воды и кристаллогидрата CrCl3∙6H2O, необходимые для приготовления 1 литра раствора, содержащего 5% (мас.) безводной соли. Плотность 5% раствора CrCl3 равна 1,05 г.
Дано: Vр-ра = 1 л ω 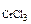 = 5% ρр-ра= 1,05 г/см3 = 5% ρр-ра= 1,05 г/см3 | РЕШЕНИЕ По определению ω 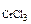 = = 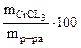 , % откуда , % откуда 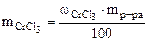 Масса раствора равна Масса раствора равна |
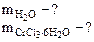 |
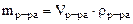
mр-ра = 1·103·1,05 =1050 г, где 103 коэффициент перевода л в см3. Тогда масса CrCl3 в растворе составляет:
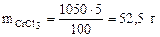
Масса CrCl3·6H2O, в которой содержится 52,5 г CrCl3, может быть найдена по пропорции:
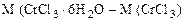 266 г/моль - 158 г/моль
266 г/моль - 158 г/моль 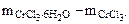
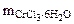 - 52,5 г
- 52,5 г
Тогда
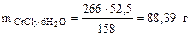
Зная массу раствора и кристаллогидрата, определяем массу воды:
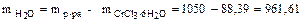 г
г
Ответ: 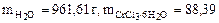 г
г
3. Написать уравнения, при помощи которых можно осуществить следующие превращения:
K2CrO4 → CrO3 → Cr2O3 → KCrO2 → Cr2(SO4)3
РЕШЕНИЕ:
1. K2CrO4+2H2SO4конц = СrO3 + 2KHSO4 + H2O
t
2. 4СrO3 = 2Cr2O3 + 3O2
t
3. Cr2O3 + 2KOH = 2KCrO2 + H2O
4. 2KCrO2 + 4H2SO4разб = K2SO4 + Cr2(SO4)3 + 4H2O
МЕТАЛЛЫ VII ГРУППЫ
УРОВЕНЬ А
1. Уравнять реакцию методом электронного баланса. Указать окислитель и восстановитель:
FeCl2 + KMnO4 +HCl→FeCl3 + MnCl2+KCl + H2O
| Дано: Уравнение реакции |
| Уравнять реакцию, указать окислитель и восстано- витель |
РЕШЕНИЕ:
Fe+2Cl2 + KMn+7O4 + HCl → Fe+3Cl3 + +Mn+2Cl2 + KCl + H2O
НОК ДМ

 восст-ль Fe+2 - e = Fe+3 5
восст-ль Fe+2 - e = Fe+3 5
окисл-ль Mn+7 + 5e = Mn+2 1
 |
5Fe+2 + Mn+7 = 5Fe+3 + Mn+2
Переносим полученные коэффициенты в молекулярное уравнение с учетом, что Cl- cодержится, также в 5 молекулах FeCl2 и определяем необходимое количество молекул HCl для получения продуктов реакции. Уравниваем Н и О → 4Н2О.
5FeCl2 + KMnO4 + 8HCl = 5FeCl3 + MnCl2 + KCl + 4H2O
УРОВЕНЬ В
1. Уравнять реакцию. Указать окислитель и восстановитель:
Na2S + KMnO4 + H2O → MnO2 + Na2SO4 + KOH
Определить Сэк(Na2S), если на взаимодействие с 4 г KMnO4 ушло 250 см3 раствора Na2S.
Дано: 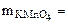 4 г 4 г 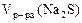 = 250 см3 = 0,25 л = 250 см3 = 0,25 л |
Уравнять реакцию, указать окислитель и восстановитель 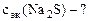 |
РЕШЕНИЕ:
Na2S-2 + KMn+7O4 + H2O→ Mn+4O2 + Na2S+6O4 + KOH
НОК ДМ

 восст-ль S-2 - 8e = S+6 3
восст-ль S-2 - 8e = S+6 3
окисл-ль Mn+7 + 3e = Mn+4 8
 |
3S-2 + 8Mn+7 = 3S0 + 8Mn+4
Переносим полученные коэффициенты в молекулярное уравнение. Уравниваем число ионов К+ и определяем количество воды → 4Н2О.
3Na2S +8KMnO4 + 4H2O =8MnO2 +3 Na2SO4 +8KOH
По закону эквивалентов: nэк(Na2S) = nэк(KMnO4)
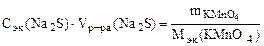 ;
;
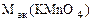 =
= 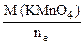 , г/моль
, г/моль
где ne - число электронов, принятых одной молекулой KMnO4.
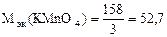 г/моль
г/моль
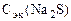 =
= 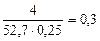 моль/л
моль/л
Ответ: 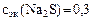 моль/л.
моль/л.
2. Уравнять реакцию. Указать окислитель и восстановитель:
Mn(OH)4 + HCl → MnCl2 + H2O + Cl2 Определить объем газа (н.у.), выделяющийся при взаимодействии 8 г гидроксида марганца (IV) с хлороводородной кислотой.
Дано: m 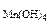 = 8 г = 8 г |
V 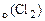 - ? - ? |
РЕШЕНИЕ:
Mn+4(OH)4 + HCl-1 →Mn+2Cl2 + Cl20 +H2O

 НОК ДМ
НОК ДМ

 восст-ль Cl-1 - e = Cl0 2
восст-ль Cl-1 - e = Cl0 2
окисл-ль Mn+4 + 2e = Mn+2 1

2Cl-1 + Mn+4 = Cl20 + Mn+2
Переносим полученные коэффициенты в молекулярное уравнение, окончательно уравниваем его, учитывая при этом количество ионов Cl-1, необходимое для получения MnCl2
Mn(OH)4 + 4HCl = MnCl2 + Cl2 + 4H2O
М 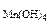 - Vo
- Vo 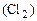
123 г - 22,4 л
8 г - х л
х = 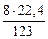 = 1,46 л
= 1,46 л
Ответ: V 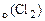 = 1,46 л
= 1,46 л
3. Уравнять реакцию. Указать окислитель и восстановитель:
MnO2 + KClO3 + KOH → K2MnO4 + KCl + H2O. Определить массу оксида марганца (IV), необходимую для восстановления 150 см3 1 н раствора KСlO3.
Дано: V 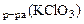 =150 см3= =0,15 л сэк(KClO3)= 1 моль/л =150 см3= =0,15 л сэк(KClO3)= 1 моль/л |
m 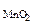 - ? - ? |
РЕШЕНИЕ:
Mn+4O2 + KCl+5O3 + KOH →
→ K2Mn+6O4 + KCl- + H2O
НОК ДМ

 восст-ль Mn+4 - 2e = Mn+6 3
восст-ль Mn+4 - 2e = Mn+6 3
окисл-ль Cl+5 + 6e = Cl- 1
 |
3Mn+4 + Cl+5 = 3Mn+6 + Cl-
Переносим полученные коэффициенты в молекулярное уравнение, уравниваем число К+, а затем Н и О:
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O
По закону эквивалентов:
nэк(KClO3) = nэк(MnO2)
V 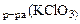 ·сэк(KClO3) =
·сэк(KClO3) = 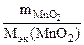
Mэк(MnO2) 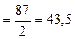 г/моль
г/моль
m 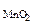 = V
= V 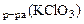 ·сэк(KClO3)∙
·сэк(KClO3)∙ 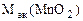
m 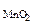 = 0,15·1∙43,5 = 6,5 г
= 0,15·1∙43,5 = 6,5 г
Ответ: m 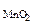 = 6,5 г
= 6,5 г
МЕТАЛЛЫ VIII ГРУППЫ
УРОВЕНЬ А
1. Используя справочные значения изменений стандартных энергий Гиббса образования веществ, определить возможность самопроизвольного протекания реакции:
OsО4(к) +4Н2(г) = Os(к) + 4Н2О(ж) при стандартных условиях. Ответ мотивировать расчетом ΔrG°(298K).
| Дано: Уравнения химической реакции. |
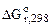 - ? - ? |
РЕШЕНИЕ:
Возможность самопроизвольного протекания реакции при 298К определяется знаком величины стандартного изменения энергии Гиббса в реакции:
если 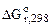 < 0, самопроизвольное протекание реакции при заданных условиях возможно;
< 0, самопроизвольное протекание реакции при заданных условиях возможно;
если 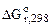 > 0, то при заданной температуре реакция невозможна. .
> 0, то при заданной температуре реакция невозможна. .
Значение 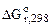 определяем по первому следствию из закона Гесса:
определяем по первому следствию из закона Гесса:
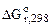 = [
= [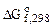 (Os(к)) + 4
(Os(к)) + 4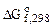 (H2O(ж))] –
(H2O(ж))] –
– [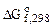 (OsO4(к)) + 4
(OsO4(к)) + 4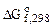 (Н2(г))]
(Н2(г))]
| OsО4(к) | + 4Н2 (г) | = Os(к) | + 4 Н2О(ж) | |
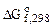 кДж/моль кДж/моль | -302,5 | 4(-237,3) |
Тогда:
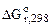 = 4(-237,3) – (-302,5) = -646,7кДж.
= 4(-237,3) – (-302,5) = -646,7кДж.
Ответ: так как 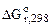 < 0, то самопроизвольное протекание реакции возможно.
< 0, то самопроизвольное протекание реакции возможно.
2. Вычислить концентрацию ионов железа в 0,01М растворе K3[Fe(CN)6], содержащем, кроме того, 0,02 моль/л цианида калия. Константа нестойкости иона [Fe(CN)6]3- в водном растворе равна 1.10-31.
Дано: с 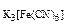 =0,01 моль/л, сKCN=0,02 моль/л, =0,01 моль/л, сKCN=0,02 моль/л, 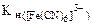 = 1.10-31 = 1.10-31 |
| [Fe3+] - ? |
РЕШЕНИЕ:
Первичная диссоциация комплексных солей протекает по типу диссоциации сильных электролитов:
K3[Fe(CN)6]=[Fe(CN)6]3-+3К+ (17.1)
Концентрация комплексного иона [Fe(CN)6]3- равна 0,01 моль/л, так как из одной молекулы комплексной соли образуется один комплексный ион.
Константа нестойкости комплексного иона [Fe(CN)6]3- характеризует следующий равновесный процесс:
[Fe(CN)6]3- <=>Fe3+ + 6CN- (вторичная диссоциация) (17.2)
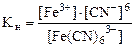 (17.3)
(17.3)
Присутствие цианида калия в растворе смещает равновесие диссо-циации комплексного иона (17.2) влево вследствие возрастания концентрации одноименного иона CN-, образующегося при диссоциации KCN:
КCN = К+ + СN-
После смещения равновесия устанавливается новое равновесие. Концентрацию Fe3+ в новом равновесии принимаем равной
х моль/л.
Общая равновесная концентрация [CN-] равна сумме концентраций CN-, образовавшихся при диссоциации КCN и [Fe(CN)6]3-:
[CN-] = 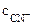 +
+ 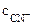
из [Fe(CN)6]3- из КCN
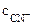 = 6х моль/л из [Fe(CN)6]3-
= 6х моль/л из [Fe(CN)6]3-
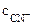 =
= 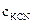 ·α·
·α· 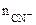 = 0,02·1·1 = 0,02 моль/л,
= 0,02·1·1 = 0,02 моль/л,
из КCN
так как КCN сильный электролит, α=1, 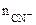 =1.
=1.
Тогда:
[CN-] = (6х + 0,02) моль/л.
Вследствие малости х, принимаем: 6х + 0,02 ≈ 0,02 моль/л.
Таким образом, выражение (17.3) примет вид:
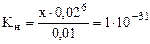 ,
,
откуда х = [Fe3+] = 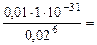 1,56·10-23 моль/л
1,56·10-23 моль/л
Ответ: [Fe3+] = 1,56·10-23 моль/л.
3. Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей: а) сульфата кобальта (II), б) хлорида палладия (II) (анод инертный). Какие продукты выделяются на аноде и катоде.

| РЕШЕНИЕ а) CoSO4= Co2+ + SO42-, K(-) A(+) инертный Co2+ + 2ē = Co SO42- 2H2O+2ē=H2+2OH- 2H2O-4ē=O2+4H+ |
На катоде выделяется Co и Н2, на аноде выделяется О2.
б) PdCl2 = Pd2+ + 2Cl-
K(-) A(+) инертный
Pd2+ + 2ē = Pd 2Cl-- 2ē = Cl2
H2O H2O
На катоде выделяется Pd, на аноде выделяется Cl2.
УРОВЕНЬ В

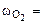 20,71% масс. В = 6 Мэк(Э) - ? Э - ?
20,71% масс. В = 6 Мэк(Э) - ? Э - ?