Пример 4. Диоксид азота при растворении в воде образует смесь двух кислот
Диоксид азота при растворении в воде образует смесь двух кислот. Напишите уравнение реакции.
Решение.
Исходными веществами являются вода и диоксид азота NO2. Кислород и водород имеют в молекуле воды степени окисления (-2) и (+1), характерные и устойчивые для них. Следовательно, реакция происходит только за счет изменения степени окисления азота. В молекуле NO2 азот находится в промежуточной степени окисления (+4), он может и отдавать, и принимать электроны по схеме:
N+4 – 1 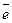 = N+5 – окисление,
= N+5 – окисление,
N+4 + 1 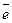 = N+3 – восстановление.
= N+3 – восстановление.
Поэтому при растворении NO2 в воде образуются азотная (  ) и азотистая (
) и азотистая ( 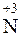 ) кислоты:
) кислоты:
2NO2 + H2O = HNO3 + HNO2.
Задания
221.С учетом степени окисления хлора в соединениях HCl, HClO3, НСlO4, определите: какое из них является только окислителем и только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
КВr + KВrO2 + H2SO4 ® Br2 + K2SO4 + Н2О.
222. Реакции представлены схемами
P + HJO3 + H2O ® H3PO4 + HJ,
KMnO4 + KNO2 + H2SO4 = MnSO4 + KNO3 + K2SO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
223. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
As3– ® As5+; N3++ ® N3–; S2– ® S°.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Na2SO3 + KMnO4+ Н2О ® Na2SO4 + MnO2 + KOH.
224. Учитывая степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите: какое соединение является только окислителем и только восстановителем? Какое соединение может проявлять как окислительные, так и восстановительные свойства, почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
PbS + HNO3 ®S + Pb (NO3)2 + NO + H2O.
225. По схемами реакций
P+ HNO3 + H2O ® H3PO4 + NO,
KMnO4 + Na2SO3 + KOH ® K2MnO4 + Na2SO4 + H2O.
составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
226. Составьте электронные уравнения и укажете, какой процесс – окисление или восстановление – происходит при следующих превращениях:
Мn6+ ®Мn2–; Cl5+ ® С1–; N3– ® N5+.
На основании электронных уравнений расставьте коэффициенты в реакции, идущей по схеме
Сu2О + HNO3 ® Cu(NO3)2 + NO+ H2O.
227 Реакции выражаются схемами.
HNO3 + Ca ® NH4NO3 + Ca(NO3)2 = H2O,
K2S + KMnO4 + H2SO4 ® S + K2SO4 + MnSO4 + H2O.
Составьте электронные уравнения. Расставьте стехиометрические коэффициенты. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
228. Учитывая степени окисления хрома, йода и серы в соединениях K2Cr2O7, КJ и H2SO3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
NaCrO2 + PbO2 + NaOH ® Na2CrO4 + Na2PbO2+ H2O.
229. Реакции протекают по схемам
H2S + Cl2 + H2O ® H2SO4 + HCl,
K2Cr2O7 + H2S + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
230. Реакции представлены схемами.
KСlO3 + Na2SO3 ® КСl + Na2SO4,
KMnO4 + HBr ® Br2 + KBr + MnBr2 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
231 Реакции протекают по схемам.
P + НlO3 + H2O ® H3PO4 + HCl,
H3AsO3 + KMnO4 + H2SO4 ® H3AsO4 + MnSO4 + K2SO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
232. Реакции представлены схемами.
NaCrO2 + Br2 + NaOH ®Na2CrO4 + NaBr + H2O,
FeS + HNО3 ® Fe (NO3)3 + S + NO + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
233. Реакции представлены схемами.
HNO3 + Zn ® N2O+ Zn(NO3)2 + H2O,
FeSO4 + KCIO3 + H2SO4 ® Fe2 (SO4)3 + КСl + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
234. Реакции протекают по схемам.
К2Сг2O7 + HCl ® CI2 + CrCI3 + KC1 + H2O,
Au + HNO3 + HCl ® AuCI3 + NO + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
235. Могут ли происходить окислительно-восстановительные реакции между веществами: a) NH3 и КМnО4; б) HNO2 и HJ; в) НСl и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
KMnO4 + KNO2 + H2SO4 ® MnSO4 + KNO3 + K2SO4 +H2O.
236. Реакции представлены схемами.
HCl + CrO3 ® Cl2 + CrCl3 + H2O,
Cd + KMnO4 + H2SO4 ® CdSO4 + K2SO4 + MnSO4 + Н2О.
237. Реакции представлены схемами.
J2 + NaOH ® NaOJ + NaJ,
MnSO4 + PbO2 + HNO3 ® HMnO4 + Pb (NO3)2 + PbSO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
238. По схемам реакций
H2SO3 + HC1O3 ® H2SO4 + HCl,
FeSO4 + K2Cr2O7 + H2SO4 ® Fe2 (SO4)3 + Cr2 (SO4)3 + K2SO4 + H2O.
составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
239. Реакции протекают по схемам.
J2 + Cl2 + H2O ®HJO3 + HCl,
FeCO3 + KMnO4 + H2SO4 ® Fe2(SO4)3 + CO2 + MnSO4 + K2SO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
240. Могут ли происходить окислительно-восстановительные реакции между веществами: a) PH3 и НBr; б) K2Cr2O7 и Н3РО3; в) HNO3 и H2S? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
AsH3 + HNO3 ® H3AsO4 + NO2 + H2O.
Электродные потенциалы и электродвижущие силы
