Основы термодинамики. Адиабатический процесс. Циклические процессы
1. Кислород, занимающий объем V1 = 5 л при давлении р1 = 1 МПа, изотермически сжимается в 3 раза. Определить конечное давление р2 и работу А, совершенную газом.
2. Газ массой m = 10 г расширяется изотермически от объёма V1 до объёма V2 = 2V1. Чему равна наиболее вероятная скорость молекул газа, если работа расширения газа А = 900 Дж.
3.Некоторый газ массой 5 г расширяется изотермически от объема V1 до объема V2=2V1. Работа расширения равна 1 кДж. Определить среднюю квадратичную скорость молекул.
4. Некоторый газ массой 1 кг находится при температуре Т=300 К и под давлением р1=0,5 МПа. В результате изотермического сжатия давление газа увеличилось в 2 раза. Работа, затраченная на сжатие А=-432 кДж. Определить: 1) какой это газ; 2) первоначальный удельный объем газа.
5. Для изобарического нагревания ν = 5 молей идеального газа от температуры Т1 = 273 К до Т2 = 373 К потребовалось сообщить газу теплоту Q = 14,54 кДж. Определить число степеней свободы молекул газа.
6. Водород массой m = 10 г нагрели на ΔT = 200 К, причем газу было передано количество теплоты Q = 40 кДж. Найти изменение Δu внутренней энергии газа и совершенную им работу А. М = 2·10-3 кг/моль.
7. Азот массой 2 кг охлаждают при постоянном давлении от 400 до 300 К. Определить изменение внутренней энергии, внешнюю работу и количество выделенной теплоты.
8. Азот массой m = 280 г расширяется изобарно при давлении P = 1 МПа. Определить работу расширения и конечный объём газа, если на расширение затрачена теплота Q = 5 кДж, а начальная температура азота Т1 = 290 К.
9. При изобарном нагревании некоторого идеального газа в количестве ν = 2 моль на ΔT = 90 К ему было сообщено количество теплоты 5,25 кДж. Определить работу, совершённую газом, изменение внутренней энергии и коэффициент Пуассона газа.
10. Для изобарного нагревания ν молей идеального газа от температуры Т1 до температуры Т2 потребовалось сообщить ему количество теплоты, равное Q. Определить показатель адиабаты газа.
11. 20 г водорода, имеющего температуру 300 К, сначала расширили адиабатно, увеличив объем в 5 раз, а затем сжали изотермически до первоначального объема. Найти температуру после адиабатного расширения и работу, совершенную в итоге газом.
12. 1 моль воздуха, имевший температуру 0°С и находившийся под давлением 5 кПа, адиабатически расширился до давления 1 кПа. На сколько градусов понизилась температура воздуха в результате расширения? Какую работу совершил газ при расширении?
13.При адиабатном сжатии кислорода массой m = 20 г его внутренняя энергия увеличилась на ΔU = 8 кДж и температура повысилась до Т2 = 900 К. Найти, на сколько повысилась температура ΔT и каково конечное давление газа P2, если начальное давление Р1 = 200 кПа.
14. Азот массой m = 1 кг занимает при температуре Т1 = 300 К объём V1 = 0,5 м3. В результате адиабатического сжатия давление газа увеличилось в 3 раза. Определить конечный объём газа, его конечную температуру и изменение внутренней энергии.
15. Азот массой m = 2 г, имеющий температуру T1 = 300 К, был адиабатно сжат так, что его объем уменьшился в n = 10 раз. Определить конечную температуру T2 газа и работу А сжатия.
16. Азот массой m = 1 кг занимает при температуре T1= 300 К объем V1= 0,5 м3. В результате адиабатического сжатия давление газа увеличилось в 3 раза. Определить: 1) конечный объем газа; 2) его конечную температуру; 3) изменение внутренней энергии газа. М = 28·10-3 кг/моль.
17.Кислород массой m = 64 г, занимающий объем V1 = 0,5 л при давлении р1= 1 МПа, расширяется в n = 3 раза. Определите конечное давление и работу, совершенную газом, если процесс адиабатический.
18.При адиабатном расширении 64 г кислорода, вначале находившемся при нормальных условиях, его объем увеличился в 3 раза. Найти изменение внутренней энергии газа и совершенную им работу.
19. В цилиндре под поршнем находится водород массой 20 г при температуре 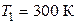 . Водород начал расширяться адиабатно, увеличив свой объем в 5 раз, а затем был сжат изотермически, причем объем газа уменьшился в 5 раз. Найти температуру
. Водород начал расширяться адиабатно, увеличив свой объем в 5 раз, а затем был сжат изотермически, причем объем газа уменьшился в 5 раз. Найти температуру 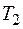 в конце адиабатного расширения и работу
в конце адиабатного расширения и работу  , совершенную газом.
, совершенную газом.
20. Над молем идеального газа совершается замкнутый цикл,
|

21. Один моль одноатомного газа совершает цикл, состоящий из двух изохор и двух изобар. При этом максимальный объем в 3 раза больше минимального, а максимальное давление в 2 раза больше минимального. Определить КПД цикла.
22. Кислород совершает цикл, состоящий из двух изохор и двух изобар, причем наибольшее давление в 2 раза больше наименьшего, а наибольший объем в 4 раза больше наименьшего. Определить термический КПД цикла.
23. Многоатомный идеальный газ совершает цикл Карно, при этом в процессе адиабатического расширения объем газа увеличивается в n = 4 раза. Определить термический к.п.д. цикла.
24. Кислород, занимающий объём V1 = 5 л при давлении p1 = 1 МПа, расширяется в n = 3 раза. Определите конечное давление и работу, совершённую газом, если процесс изотермический. Чему равно изменение энтропии газа, если его масса 64 г?
25. 64 г кислорода изобарно нагрели так, что его объем увеличился в 2 раза, а затем изохорно охладили так, что давление упало в 2 раза. Определить приращение энтропии газа.
26. Азот, занимавший объём V1 = 10 л под давлением P1 = 0,2 МПа, изотермически расширился до объёма V2 = 28 л. Определить работу А расширения газа, количество теплоты Q, полученное газом и изменение энтропии одного моля газа.
27. Кислород массой m = 10 г нагревают от температуры t1 = 50°С до температуры t2 = 150°С. Найти приращение ΔS энтропии, если нагревание происходит: а) изохорически; б) изобарически.
28. Водород массой m = 100 г был изобарно нагрет так, что его объем увеличился в 3 раза, затем этот водород был изохорно охлажден так, что его давление уменьшилось 3 раза. Найти изменение энтропии в ходе указанных процессов.
29. Как изменится энтропия 2 г водорода, занимающего объем 40 л при температуре 270 К, если давление увеличить вдвое при постоянной температуре, а затем изохорно повысить температуру до 320К? Молярная масса водорода равна 0,002 кг/моль.
30. 1,7 г гелия адиабатически расширили до втрое большего объема, а затем изобарно сжали до первоначального объема. Чему равно изменение энтропии газа за весь процесс?
31.Идеальный одноатомный газ (ν = 2 моль) сначала изобарно нагревали, так что объем газа увеличился в n1 = 2 раза, а затем изохорно охладили, так что давление его уменьшилось в n2= 2 раза. Определить приращение энтропии в ходе указанных процессов.
32.Давление v молей газа в некотором процессе изменяется прямо пропорционально его объему. Найти изменение энтропии газа при увеличении его объема в n раз, если его показатель адиабаты равен γ.
33.Процесс расширения двух молей аргона происходит так, что давление газа увеличивается прямо пропорционально его объему. Найти изменение энтропии газа при увеличении его объема в два раза.
34. Найти изменение энтропии ΔS при переходе массы m = 8 г кислорода от объема V1 = 10 л к объему V2 = 40 л при температуре Т = 353 К.
35. Найти изменение энтропии ΔS при переходе массы m = 8 г кислорода от объёма V1 = 10 л при температуре t1=80ºC к объёму V2 = 40 л при температуре t2 = 300ºC.
36. Чему равно изменение энтропии 8 г кислорода при расширении от объема 10 л до объема 40 л, если начальная температура равна 30°С, а конечная – 300°С?
37.Найти изменение энтропии ΔS при превращении массы m = 10 г льда (t = – 20ºС) в пар (t = 100ºС). Сл = 2100 Дж/кг·К, λ = 335 кДж/кг, Св = 4200 Дж/кг·К, τ = 2,3 МДж/кг.
38. Лед массой 2 кг, находящийся при температуре -130С, нагрели до 00С и расплавили. Определить изменение энтропии. (λ=3,35.105 Дж/кг, Сльда=2,1.103 Дж/(кг.К))
39. Лед массой 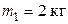 при температуре
при температуре 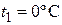 был превращен в воду той же температуры с помощью пара, имеющего температуру
был превращен в воду той же температуры с помощью пара, имеющего температуру 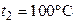 . Определить массу
. Определить массу 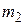 израсходованного пара. Каково изменение
израсходованного пара. Каково изменение 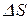 энтропии системы лед-пар?
энтропии системы лед-пар? 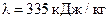 ,
, 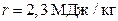 ,
, 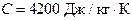 .
.
40. Кусочек меди массы 300 г, имеющий температуру 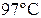 , поместили в калориметр, в котором находится 100 г воды при
, поместили в калориметр, в котором находится 100 г воды при 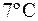 . Найти изменение энтропии системы за время выравнивания температуры. Теплоемкостью калориметра можно пренебречь.
. Найти изменение энтропии системы за время выравнивания температуры. Теплоемкостью калориметра можно пренебречь. 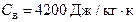 ,
, 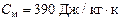 .
.
41.Смешали воду массой m1 = 5 кг при температуре Т1 = 280 К с водой m2 = 8кг при температуре Т2 = 350 К. найти: 1) температуру Т смеси; 2) изменение энтропии ΔS, произошедшее при смешивании. Удельная теплоемкость воды с = 4200 Дж/кг.
42. Определить удельную теплоемкость СР смеси кислорода и гелия, если количество вещества ν1 первого компонента равно 2 моль, а количество вещества ν2 второго равно 4 моль.
43. Чему равна удельная теплоемкость при постоянном объеме смеси из 3-х молей неона и 2-х молей гелия, молярные массы которых равны соответственно 20 г/моль и 4 г/моль?
44. Вычислить удельную теплоёмкость СV смеси неона и водорода. Массовые доли газов соответственно равны w1 = 0,8 и w2 = 0,2. М1 = 20·10-3 кг/моль, М2 = 2·10-3 кг/моль.
45. В баллоне находятся гелий и азот. Определить удельную теплоемкость сV смеси этих газов, если массовые доли гелия и азота одинаковы и равны 0,5. Молярные массы гелия и азота равны соответственно 4 г/моль и 28 г/моль
46.Газовая смесь состоит из азота массой 2 кг и аргона массой 1 кг. Принимая газы за идеальные, определить удельные теплоемкости СVиСР газовой смеси.Мазота = 28·10-3 кг/моль, Маргона = 40·10-3 кг/моль.
47. Вычислить постоянную Пуассона для газовой смеси, состоящей из двух молей кислорода и трех молей углекислого газа. М1 = 32·10-3 кг/моль, М2 = 44·10-3 кг/моль.
48. Определите коэффициент Пуассона γ для смеси газов, содержащей гелий массой m1 = 8 г и водород массой m2 = 2 г. М1 = 4·10-3 кг/моль, М2 = 2·10-3 кг/моль.
49.Чему равен коэффициент Пуассона для газовой смеси, состоящей из 7 г азота и 20 г гелия. Маз = 28·10-3 кг/моль, Мг = 4·10-3 кг/моль.
