Основы термодинамики. I начало термодинамики
1. Какими независимыми параметрами можно характеризовать состояние равновесной термодинамической системы в отсутствии внешних полей?
2. Как принято называть соотношение, связывающее между собой значения термодинамических параметров вещества в состоянии термодинамического равновесия. Какой вид имеет это соотношение для идеального газа?
3. Что такое состояние термодинамического равновесия?
4. Что такое коэффициент объемного расширения и как он зависит от температуры идеального газа?
5. Что такое коэффициент изотермической сжимаемости? Вычислите этот коэффициент для идеального газа?
6. Что такое термический коэффициент давления, вычислите для идеального газа.
7. Как можно подсчитать работу, произведенную термодинамической системой при переходе ее из одного состояния в другое? Зависит ли эта работа от характера термодинамического процесса, пройденного системой?
8. Является ли бесконечно малое приращение работы полным дифференциалом в математическом отношении? Какие термодинамические процессы называются обратимыми?
9. Что такое круговой термодинамический процесс? Являются ли все круговые процессы обратимыми?
10.Каким физическим и математическим условиям должна удовлетворять величина, которую можно назвать функцией состояния системы?
11.Что называется внутренней энергией системы? Является ли внутренняя энергия функцией состояния системы?
12.Что такое теплоемкость тела? При каких условиях эта величина приобретает определенный физический смысл?
13.В каких пределах изменяются возможные значения теплоемкости?
14.При каких условиях теплоемкость бывает отрицательной величиной?
15.В чем содержание первого закона термодинамики? Как записывается математически первый закон термодинамики?
16.Напишите первый закон термодинамики для всех изопроцессов.
17.В каких случаях внутренняя энергия системы постоянна?
18.В каких случаях изменение внутренней энергии системы равно внешней работе, совершенной системой?
19.Какие выражения для внутренней энергии газа, теплоемкость которого не зависит от температуры, можно записать, пользуясь первым законом термодинамики?
20.Исходя из первого закона термодинамики, найти связь между молярными теплоемкостями СP и СV.
21.В чем физическая причина различия значений теплоемкостей СP и СV для случая идеального газа?
22.Получите уравнение адиабатического процесса для идеального газа из I закона термодинамики.
23.Чем физически объясняется различие крутизны адиабаты и изотермы идеального газа в системе координат PV?
24.Какому условию удовлетворяют процессы, называемые политропическими. Запишите уравнение этого процесса.
25.При постоянной температуре концентрация молекул газа уменьшилась в 2 раза. Какие параметры при этом изменились?
26.Как меняется концентрация газа для трех процессов: изотермического, изохорического, изобарического?
27.Как записываются полные дифференциалы любого термодинамического параметра?
28.Изобразите изохорический, изобарический, изотермический и адиабатический процессы в системе координат РТ.
29.Изобразите изохорический, изобарический, изотермический и адиабатический процессы в системе координат VT.
30.Изобразите изохорический, изобарический, изотермический, адиабатический процессы в системе координат U, Т, где U-внутренняя энергия.
31.В каких пределах может изменяться теплоемкость идеального газа для политропических процессов?
32.Запишите выражение для элементарной работы при изохорических, изобарических, изотермических и адиабатических процессах.
33. На какую физическую величину отличается молярная теплоемкость при постоянном давлении от молярной теплоемкости при постоянном объеме?
34. Как связаны молярная и удельная теплоемкости данного газа между собой?
35.Укажите общий порядок расчета теплоемкости любого политропического процесса идеального газа по заданному уравнению состояния газа.
36.Каков общий способ определения уравнения процесса данного газа по заданному значению теплоемкости?
37. Какие процессы изменения состояния газа характеризуются отрицательной величиной теплоемкости?
38. Начертить график зависимости теплоемкости от показателя политропы для политропических процессов.
39.Нагревается или охлаждается идеальный газ, если он расширяется по закону P= 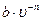 , n<1, где b - постоянная величина, υ - объем газа.
, n<1, где b - постоянная величина, υ - объем газа.
40.Нагревается или охлаждается идеальный газ, если он расширяется при постоянном давлении?
41.При каких значениях показателя политропы идеальный газ нагревается при сжатии, а при каких охлаждается?
42.На координатах PV изобразите изотермическое сжатие массы газа m при температуре Т. Как изменится вид графика, если изотермическое сжатие той же массы газа будет происходить при более высокой температуре Т1? Как изменится вид графика, если при той же температуре Т в процессе будет участвовать большая масса газа m1?
43.На графике (рис.1) представлен изобарический переход газа из состояния I в состояние II. Какому из этих состояний отвечает более высокая температура? Как изменится вид графика, если взять большую массу при том же начальном объеме?
44.На рис. 2 изображен график изохорического перехода идеального газа из состояния I в состояние II. В каком из состояний температура газа выше? Как изменится график, если взять большую массу газа при том же начальном давлении?
45.Некоторая масса идеального газа переведена из состояния I в состояние II. (Рис.3). В каком из этих состояний газ обладает большим объемом?
46.На рис.4 изображен процесс перехода из состояния I в состояние II. Как идет этот процесс: с увеличением или уменьшением давления?

47.Начертите график зависимости плотности ρ от температуры Т при изотермическом, изобарическом и изохорическом процессах.
48.Как запишется первое начало термодинамики для изохорического, изотермического, изобарического и адиабатного процессов?
49.Какова теплоемкость газа при изотермическом и адиабатном процессах?
50. Уравнение политропического процесса PV 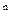 =const. Каким изопроцессам отвечают значения C=0, C=CV, С=СP, С→ ∞.
=const. Каким изопроцессам отвечают значения C=0, C=CV, С=СP, С→ ∞.
51.Идеальный газ совершает процесс, в ходе которого давление р растет пропорционально объему V. Является ли этот процесс политропическим?
52.Нагревается или охлаждается идеальный газ, если он расширяется по закону рV2=const.
53.Выразите молярную теплоемкость С идеального газа при политропическом процессе через показатель политропы n и отношение теплоемкостей γ.
54.Идеальный газ расширяется в ходе политропического процесса. При каких значениях показателя политропы n температура газа будет возрастать.
II начало термодинамики
I начало термодинамики не даёт указаний относительно направления, в котором могут происходить процессы в природе. Для изолированной системы I закон термодинамики требует только то, чтобы при всех процессах энергия системы оставалась постоянной. Если 1 и 2 – два состояния такой системы, то I закон ничего не может сказать, будет ли система переходить из состояния 1 в состояние 2, или из состояния 2 в состояние 1. Пусть два тела находятся в адиабатической оболочке и взаимодействуют между собой. Тогда Q1=-Q2, т.е. тепло Q1 полученное одним телом, равно теплу Q2, отданному другим телом. В каком направлении будет переходить тепло, I закон термодинамики не отвечает. Согласно I закону тепло может переходить от менее нагретого к более нагретому, хотя в действительности такой процесс самопроизвольно не идёт. I закон термодинамики не даёт количественную меру температуры.
II начало термодинамики, наоборот, позволяет судить о направлении процесса. Кроме того, II закон термодинамики позволяет решить вопрос о количественной мере температуры и позволяет построить температурную шкалу, не зависящую от произвола выбора термометрического тела и устройства термометра.
