Составление окислительно-восстановительных реакций
Составить уравнение окислительно-восстановительной реакции – значит определить какие продукты реакции образуются и найти коэффициенты перед всеми веществами.
Одним из методов определения коэффициентов в уравнении реакции является метод электронного баланса. В основе этого метода лежит нахождение коэффициентов перед молекулами восстановителя и окислителями, при которых суммарное число электронов, отданных
восстановителем, равно суммарному числу электронов, присоединенных окислителем.
Рассмотрим этот метод на простейшем примере окисления алюминия кислородом:  + O2 →
+ O2 →  2O3.
2O3.
Алюминий – металл, он является восстановителем. Атом алюминия отдает 3 электрона. Кислород – неметалл, он является окислителем. Молекула кислорода принимает 4 электрона, образуя два иона кислорода (всегда нужно определять число принятых или отданных электронов молекулой реагирующего вещества). Находим наименьшее общее кратное число отданных и полученных электронов, умножая 3 на 4. Это число указывает на количество электронов, принимающих участие в окислительно-восстановительной реакции:


 – 3ē =
– 3ē = 
 2 + 4ē = 2
2 + 4ē = 2 
Чтобы восстановитель отдал 12 электронов, должно быть 4 атома алюминия. Чтобы окислитель присоединил 12 электронов, должно быть 3 молекулы кислорода:




 – 3ē =
– 3ē =  4
4


 O2 + 4ē = 2O 3
O2 + 4ē = 2O 3
В левой частях уравнения реакции 4 атома алюминия, в правой части должно быть столько же, т. е. перед Al2O3 нужно поставить коэффициент 2: 4Al + 3O2 = 2Al2O3.
Проверка на кислород показывает, что в левой и правой части уравнения 6 атомов кислорода. Коэффициенты в уравнении реакции расставлены правильно.
Коэффициенты, стоящие перед восстановителем и окислителем, можно увеличивать или уменьшать, не изменяя их соотношения, полученного при составлении схемы электронного баланса.
Часто в окислительно-восстановительных реакциях, происходящих в растворах, принимает участие третий компонент – среда. Например,
K  + K2
+ K2 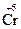 2O7 + H2SO4 →
2O7 + H2SO4 →  2 +
2 + 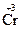 2(SO4)3 + K2SO4 + H2O.
2(SO4)3 + K2SO4 + H2O.
В этой реакции восстановителем является иодид калия, а окислителем – дихромат калия. Составляем схему электронного баланса:






 - 1ē =
- 1ē =  6
6
2 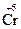 + 6ē = 2
+ 6ē = 2 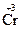 1
1
Один ион иода отдает 1 электрон, а два атома хрома принимают 6 электронов. Отсюда получаются коэффициенты перед молекулами восстановителя и окислителя 6 и 1. Эти коэффициенты определяют соотношение между числом молекул восстановителя и его окисленной формой, с одной стороны, и числом молекул окислителя и его восстановленной формой, с другой:
6KJ + K2Cr2 O7 + H2SO4 → 3J2 + Cr2(SO4)3 + K2SO4 + H2O.
Серная кислота необходима для связывания в соль образовавшихся катионов K+ и Cr+3. Количество молекул K2SO4 определяется суммарным числом атомов калия в левой части уравнения: из 8 атомов калия получается 4 молекулы K2SO4. Для образования одной молекулы Сr2(SO4)3 и четырех молекул K2SO4 необходимо 7 молекул серной кислоты. Ионы водорода в кислой среде образуют воду. Количество молекул воды определяется количеством атомов водорода, содержащихся в 7 молекулах серной кислоты. Таким образом, законченное уравнение этой реакции имеет вид
6KJ + K2Cr2 O7 + 7H2SO4 = 3J2 + Cr2(SO4)3 +4K2SO4 + 7H2O.
Правильность составления уравнения реакции определяется подсчетом атомов кислорода в левой и правой частях уравнения реакции: 35 = 35.
В некоторых случаях роль среды играет окислитель или восстановитель. Тогда в уравнении реакции формулу окислителя (или восстановителя) полезно написать дважды.
В качестве примера рассмотрим окисление меди разбавленной азотной кислотой. Азотная кислота здесь играет двойную роль – роль окислителя и среды:
3  + 2H
+ 2H  O3 + 6HNO3 (среда) = 3
O3 + 6HNO3 (среда) = 3  (NO3)2 + 2
(NO3)2 + 2  O + 4H2O;
O + 4H2O;





 - 2ē =
- 2ē =  3
3
 + 3ē =
+ 3ē =  2
2
Две молекулы азотной кислоты играют роль окислителя. В этих молекулах изменяется степень окисления азота. Кислотные остатки шести других молекул связываются с образовавшимися катионами Cu2+.
Молекулы некоторых веществ могут проявлять как восстановительные, так и окислительные функции. В этом случае возможны реакции самоокисления-самовосстановления, или диспропорционирования. Примером такой реакции является реакция разложения азотистой кислоты на оксид азота (II), азотную кислоту и воду. При составлении уравнения реакции этого типа формулу одного и того же вещества полезно записать дважды:
H  O2 + 2H
O2 + 2H  O2 = H
O2 = H  O3 + 2
O3 + 2  O + H2O;
O + H2O;


 - 2ē =
- 2ē =  1
1
 + 1ē =
+ 1ē =  2
2
Как следует из этого уравнения одна молекула HNO2 является восстановителем, превращаясь в одну молекулу HNO3, а две другие ее молекулы выступают в роли окислителя, образуя две молекулы NO.
Существуют вещества, в молекулах которых есть атомы, способные отдавать, и атомы, способные принимать электроны. Разложение этих веществ представляет собой реакцию внутримолекулярного окисления-восстановления:
(  H4)2
H4)2 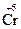 2O7 =
2O7 =  2 +
2 + 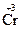 2O3 + 4H2O;
2O3 + 4H2O;



 2
2  – 6ē =
– 6ē =  2 6 1
2 6 1
2 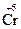 + 6ē = 2
+ 6ē = 2 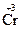 6 1
6 1
В этой реакции азот в ионе NH4+ отдает электроны хрому в дихромат-ионе.
