Кислотно-основное титрование
Вопросы и примеры задач для подготовки к К/Р №2
Количественный анализ
Основы титриметрии
- Титриметрический анализ. Классификация метода.
- Общая характеристика титриметрического метода. Точка эквивалентности и конечная точка титрования.
- Линейные и логарифмические кривые титрования. Скачок на кривой титрования.
- Основные расчетные соотношения в титриметрии.
- Визуальные методы регистрации конечной точки титрования.
- Интервал перехода окраски индикатора и показатель титрования.
- Основные источники систематических погрешностей в титриметрии.
- Индикаторные погрешности в титриметрии. Выбор индикатора.
Кислотно-основное титрование
- Метод кислотно-основного титрования. Общая характеристика метода.
- Характеристика некоторых кислотно-основных индикаторов (метиловый оранжевый, фенолфталеин).
- Титрование сильных кислот и оснований.
- Титрование слабых кислот и оснований.
- Титрование многоосновных кислот и многокислотных оснований.
- Приготовление стандартных растворов кислот и оснований. Стандартизация растворов кислот и оснований.
- Титрование смесей фосфатов, карбонатов.
- Определение аммиака в солях аммония. Титрование борной кислоты.
Кислотно-основное титрование
Пример 1. Какую навеску негашеной извести, содержащей 90% СаО и 10% индифферентных примесей, требуется взять для анализа, чтобы на ее нейтрализацию израсходовать 20,00 мл раствора HCl с титром по СаО 0,009000 г/мл?
Решение. Масса СаО соответствующая указанному объему титранта будет равна m(CaO)=T(HCl/CaO)×V(HCl)=0.009000×20=0.18 г. Отсюда для массы навески имеем 0.18/0.9=0.2 г.
Пример 2. Навеска хлорида аммония обработали избытком щелочи. Выделившийся аммиак поглощен 50,00 мл 0,5120 М HCl и полученный раствор разбавлен до 250,0 мл. На титрование 50.00 полученного раствора израсходовано 25,73 мл 0,04870 M KOH. Какова масса NH3, содержащегося в хлориде аммония.
Решение. Число молей НСl, введенное с исходным раствором кислоты, составит n1=cHCl×VHCl=0,05000×0,5120=0.02560. С учетом разбавления этого раствора до 250 мл (Vt) найдем число молей НСl, взятое для анализа (п2)
n2=n1×Val/Vt=0.02560×50,00/250=,0.005120
где Val - объем разбавленного раствора НСl, взятый для анализа.
Число молей КОН (п3), израсходованное на титрование избытка кислоты, определим из формулы n3=cKOHVKOH=0,04870×25,73=
Очевидно, число молей аммиака, содержащегося в аликвотной части раствора п4=п2-n3. Отсюда mNH3=n4×Vt×M(NH3)/Val=0,3293 г
Пример 3. Постройте кривую титрования 25,00 мл 0,1000 М раствора малеиновой кислоты 0,1000 М раствором гидроксида натрия.
Решение. Значение рН раствора малеиновой кислоты до начала титрований, было вычислено ранее (см. пример выше); рН=1,54.
Вычисление рН до первой точки эквивалентности. После прибавления раствора щелочи неоттитрованная малеиновая кислота H2M и сопряженное основание НМ- образуют буферный раствор. Учитывая, что по первой ступени диссоциации малеиновая кислота является кислотой средней силы, расчет следует вести по уравнению:
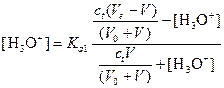 .
.
После преобразования этого выражения имеем:
 .
.
Например, после добавления 5 мл раствора NaOH и подстановки в приведенное выше выражение получаем квадратное уравнение
[H3O+]2+2.87×10-2[H3O+]-8.00×10-4=0,
решением которого будет [Н3О+]=1,74×10-2 М, рН=1,7б.
Аналогичным образом вычисляют рН во всех точках первой буферной области.
Первая точка эквивалентности. В первой точке эквивалентности имеем раствор амфолита HM- и расчет следует вести с помощью выражения
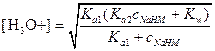
Ясно, что числитель в этом уравнении можно упростить. С другой стороны, концентрация НМ- сравнима с величиной Ka1 поэтому
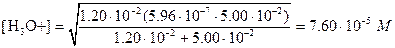
рН=4,12.
Вторая буферная область. Дальнейшее прибавление щелочи приводит к образованию нового буферного раствора, состоящего из неоттитрованной кислоты НМ- и сопряженного с ней основания М2-. Если основание добавлено в количестве, достаточном для того, чтобы пренебречь реакцией взаимодействия НМ- с водой с образованием ОН- (несколько десятых долей миллилитра), рН смеси легко вычислить из Кa2. Для примера вычислим рН после прибавления 25,50 мл раствора NaOH:
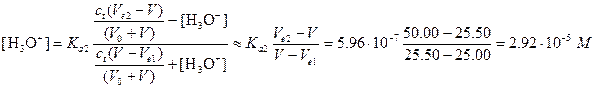 Предположение, что [Н3О+] и [ОН-] малы в сравнении с обеими общими концентрациями, оказалось справедливым, поэтому рН=4,54.
Предположение, что [Н3О+] и [ОН-] малы в сравнении с обеими общими концентрациями, оказалось справедливым, поэтому рН=4,54.
Вторая точка эквивалентности. После прибавления 50,00 мл 0,1000 М раствора NaOH к 25,00 мл 0,1000 М раствора Н2М получим 0,0333 М раствор Na2M. Доминирующим равновесием в этой системе является реакция взаимодействия М2- с водой, и только оно должно быть принято во внимание. Таким образом,
М2-+Н2ОÛОН-+НМ-,
Поскольку Kb1=Kw/Ka2=1.68×10-8 относительно мала, значение во второй точке эквивалентности можно найти по упрощенной формуле
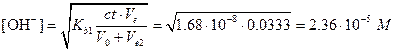 ,
,
рН=14,00-lg(2,36×10-8)=9,37.
Вычисление рН за второй точкой эквивалентности. При дальнейшем прибавлении щелочи диссоциация М2- будет подавлена, поэтому рН раствора рассчитывают по избытку прибавленного титранта.
Пример 4. Раствор содержит одно или несколько из следующих веществ: Na2CO3, NаHCO3, NaOH. На титрование 50,0 мл раствора в присутствии фенолфталеина затратили 22,1 мл 0,100 н. НСl. Вторую порцию раствора объемом 50,0 мл оттитровали в присутствии бромкрезолового зеленого, причем вблизи второй точки эквивалентности раствор прокипятили для удаления CO2. На титрование пошло точно 48,4 мл НСl. Каков состав исходного раствора?
Решение. Если бы раствор содержал только NaOH, на его титрование с любым индикатором были бы затрачены одинаковые объемы кислоты (т.е. Vфф=Vбк). В действительности, однако, на второе титрование пошло 48,4 мл. Поскольку на первое титрование израсходовано меньше половины этого объема, раствор кроме Na2CO3 должен содержать некоторое количество NaHCO3. Теперь мы можем рассчитать концентрации обоих компонентов. В момент достижения рН перехода окраски фенолфталеина первоначально присутствовавший в растворе СО32- превращается в НСО3-. Поэтому
n(Na2CO3)=22,1×0.100/1000=2,21×10-3.
На титрование от точки перехода окраски фенолфталеина до точки перехода окраски бромкрезолового зеленого пошло 48,4—22,1=26,3 мл НС1. Этим количеством кислоты оттитровывается как первоначально присутствовавший бикарбонат, так и бикарбонат, образовавшийся из карбоната. Следовательно,
n(NaHCO3)-n(Na2CO3)=26,3×0,100/1000.
Отсюда
n(NaHCO3) =(2,63-2,21)×10-3=4.2×10-4.
Из этих данных легко рассчитать молярные концентрации:
cNa2CO3=2.21/50=0.0442 ммоль/мл,
cNaHCO3=0,42/50=0.0084 ммоль/мл.
Пример 5. Для определения постоянной жесткости воды к 100 мл воды прибавили 30,00 мл раствора Nа2СО3 (T(Na2CO3/CaO)=0,001025), полученную смесь выпарили досуха и сухой остаток растворили в дистиллированной воде. На титрование фильтрата израсходовано 25,00 мл НСl (ТНС1/СаО=0,000812). Сколько миллиграммов СаО в 1 л воды?
Решение. Масса СаО (в мг), содержащаяся в 100 мл воды, взятой для анализа, находим как разность:
m¢=(T(Na2CO3/CaO)×V(Na2CO3)-T(HCl/CaO)×V(HCl))×1000
Отсюда содержание СаО (мг) на 1 л воды составит
m=m¢×1000/100=104,5 мг
Пример 6. Чему равна индикаторная ошибка титрования 0.1 M HCl 0,1 M раствором NaOH с метиловым красным (рТ=5.1)?
Решение. Поскольку титрование закончится при рН 5,1, то сильная кислота в растворе будет недотитрована и
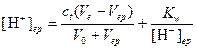
Относительная погрешность титрования будет равна
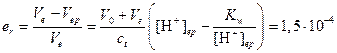
Ошибка мала, поэтому для титрования пригоден индикатор метиловый красный.
Пример 7. Можно ли оттитровать 0,02 M NаОН 0,02 M раствором НСl с: а) фенолфталеином (рТ=9); б) метиловым оранжевым (рТ=4)
Решение. а) Точка эквивалентности достигается в этом случае при рН=7. По окончании титрования (рН=9) в растворе еще имеется неоттитрованная сильная щелочь, поэтому относительную индикаторную погрешность следует рассчитывать по формуле
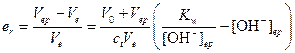
Поскольку V0»Vep»Ve, из приведенного уравнения имеем er»-10-3 . Следовательно, индикатор вполне пригоден для титрования.
6) В этом случае титрование заканчивается при наличии в растворе избытка сильной кислоты (рН=4), т. е. раствор будет перетитрован:
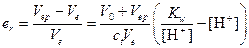
или er»10-2
Большая ошибка не позволяет использовать индикатор метиловый оранжевый в данном титровании.
Пример 8. Вычислить ошибку титрования 0,1 М этаноламина 0,1 М раствором НСl с: а) метиловым красным (рТ=5); б) фенолфталеином (рТ=9).
Решение. В этой задаче применим общий подход для нахождения индикаторной погрешности титрования.
Согласно принципу электронейтральности,
[H+]+[RNH3+]=[Cl-]+[OH-].
Концентрацию иона RNH3+ в любой момент титрования можно рассчитать по уравнению
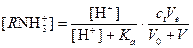 ,
,
где Ka - константа диссоциации RNH3+ (Ka=Kw/Kb, Kb=1,8×10-5).
Концентрация Cl- будет равна

Подставим значения указанных концентраций в уравнение электронейтральности
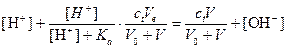
Преобразуя данное уравнение, для относительной индикаторной погрешности имеем
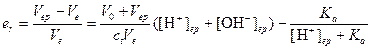 .
.
а) При использовании метилового красного титрование заканчивается при рН 5,0. Отсюда er=1,4×10-4 (0.014%). Так как погрешность положительна раствор несколько перетитрован, однако погрешность мала и индикатор метиловый красный пригоден для титрования
б) При титровании с фенолфталеином титрование заканчивается при рН 9. Относительная погрешность титрования в этом случае будет следующей: er= -3.6×10-1 (36%). Из этого значения погрешности следует, что значительная часть первоначально взятого амина остается неоттитрованной. Следовательно, индикатор фенолфталеин непригоден для данного титрования.
Задачи
1. Вычислите концентрацию раствора H2SO4 в моль/л, титр которого равен 0,02446 г/мл.
2. В воде растворили 28,00 г х.ч. KOH и 40,20. г х.ч. NaOH и разбавили раствор до 1500 мл. Рассчитайте концентрацию полученного раствора как титранта для титрования кислот.
3. Вычислите концентрацию раствора NaOH в моль/л, титр которого равен 0,004020 мг/мл.
4. К 550 мл 0,1925 М HCl прибавили 50,00 мл раствора HCl с титром 0,02370 г/мл. Вычислите концентрацию и титр полученного раствора.
5. Вычислите концентрацию раствора HCl в моль/л, если Т(HCl/KOH)= 0,01353 г/мл.
6. Сколько мл воды надо добавить к 1 л 0,5300 М HCl, чтобы получить 0,5000 М раствор?
7. Вычислите концентрацию раствора NaOH в моль/л, если Т(NaOH/CaO) = 0,002914 г/мл.
8. Сколько мл HCl (d=1,19 г/см3) необходимо для приготовления 1,0 л 0,1 М раствора?
9. Концентрация раствора H2SO4 равна 0.0504 М. Рассчитайте Т(H2SO4).
10. Концентрация раствора NaOH равна 0.09981 М. Рассчитайте Т(NaOH/H3PO4).
11. Концентрация раствора NaOH равна 0.01097 М. Рассчитайте Т(NaOH/SO3).
12. Концентрация раствора KOH равна 0.01097 М. Рассчитайте Т(KOH/SO2).
13. Вычислите концентрацию раствора HClO4 в моль/л, титр которого равен 0,01445 г/мл.
14. Вычислите концентрацию раствора NaOH в моль/л, если Т(NaOH/SO3) = 0,02174 г/мл.
15. Сколько мл серной кислоты (d=1.835 г/см3) требуется для приготовления 2,5 л 0,1 М раствора?
16. Сколько г щелочи, содержащей 98% NaOH и 2% индифферентной примесей, необходимо для приготовления 200 мл 0,1 М раствора?
17. Определить Т(KOH/P2O5) раствора едкого кали, используемого при определении Р2O5 в суперфосфате (Н3РО4 титруется до KH2PO4), если на титрование 18,00 мл 0,09064 М HCl израсходовано 19,32 мл KOH.
18. До какого объема нужно довести раствор, в котором содержится 1,530 г NaOH, чтобы на титрование 20,00 л раствора израсходовать 14,70 мл HCl (T(HCl)=0,003800)?
19. Вычислить число граммов N2O5 на 1 мл раствора HNO3, если на титрование 20,00 мл раствора кислоты израсходовано 21,12 мл 0,1120 М NaOH.
20. На титрование раствора, полученного из 0,1370 г щавелевой кислоты, израсходовано 22,10 мл 0,09840 М NaOH. Сколько молекул кристаллизационной воды содержала кислота?
21. Навеску 2,0712 г технической буры растворили в мерной колбе емкостью 100 мл. На титрование 20,00 мл раствора израсходовали 21,80 мл HCl (T(HCl/NaOH) =0,003974). Вычислить процентное содержание х.ч. Na2B4O7×10H2O.
22. Навеску 1,000 г суперфосфата обработали водой. На титрование фильтрата до перехода Н3РO4 в NaH2PO4 израсходовали 17,60 мл раствора NaOH (T(NaOH/P2O5) = 0,007251). Вычислить процентное содержание P2O5 в суперфосфате.
23. Для анализа взяли 50,00 мл раствора соляной кислоты и разбавили водой до 1000 мл. На титрование 20,00 мл раствора NaOH (Т(NaOH/h2so4) = 0,004189) израсходовали 18,20 мл полученного раствора кислоты. Вычислить концентрацию HCl в исходном растворе (г/л).
24. На нейтрализацию 0,4000 г смеси, состоящей из х.ч. карбонатов натрия и калия, израсходовали 22,00 мл 0,3000 М раствора кислоты. Вычислить процентное содержание Na2CO3 и K2CO3 в смеси.
25. Какую навеску х.ч. NaNO3 взяли для анализа по методу восстановления NO3- до NH3, если выделившийся аммиак был поглощен 40,00 мл 0,1245 М HCl и избыток кислоты оттитрован 22,40 мл 0,1002 М NaOH?
26. Навеску (NH4)2SO4 растворили в мерной колбе емкостью 100 мл. К 20,00 мл раствора прибавили 50,00 мл 0,1122 М NaOH и нагрели до полного удаления NH3. Остаток щелочи оттитровали 18,00 мл раствора HCl (20,00 мл раствора NaOH эквивалентны 21,00 мл раствора HCl). Сколько граммов (NH4)2SO4 содержалось в растворе?
27. Навеску 0,1032 г Na2CO3 обработали 50,00 мл 0,09496 М HCl, избыток кислоты оттитровали 24,80 мл 0,1298 М NaOH. Вычислить процентное содержание индифферентных примесей в образце.
28. К 0,4789 г. смеси х.ч. SrCO3 и х.ч. Li2CO3 добавили 40,00 мл 0,5100 М HCl. Избыток кислоты оттитровали 20,00 мл NaOH (T(NaOH/ HCl) = 0,01825). Вычислить процентное содержание SrCO3 и Li2CO3.
29. Какую навеску нашатыря, содержащего около 30% NH3, взяли для анализа, если после добавления к ней 50,00 мл 0,1000 М NaOH и нагревания до полного удаления аммиака, избыток NaOH оттитровали 25,00 мл 0,1000 М HCl?
30. Навеску 2,0000 г неизвестного вещества растворили в мерной колбе емкостью 100 мл. На титрование 25,00 мл раствора израсходовали 20,00 мл 0,4455 М HCl. Определить, что входило в состав анализируемого вещества: КОН или NaOH.
31. Какую навеску х.ч. безводной соды нужно взять, чтобы на ее титрование до СО3 израсходовать 20 мл 0,1 М HCl?
32. Молярную концентрацию раствора H2SO4 была установлена по карбонату кальция, содержащему 91,90% СаСO3 без примеси других оснований. К навеске 0,6724 г добавили 29,87 мл кислоты и избыток ее оттитровали 10,27 мл раствора NaOH (1 мл H2SO4 эквивалентен 1,024 мл NaOH). Вычислить молярную концентрацию H2SO4 и NaOH.
33. На титрование 50.00 мл раствора, содержащего соляную и фосфорную кислоту, израсходовано 25.00 мл 0.1000 М раствора гидроксида натрия в присутствии метилового красного. Если продолжить титрование в присутствии тимолового синего, то расходуется еще 10.0 мл раствора гидроксида натрия. Рассчитайте концентрации соляной и фосфорной кислот.
34. Раствор, в котором может находиться одно из веществ: NaOH, NaНCO3, Na2CO3 - или одна из смесей: NaOH+Na2CO3; Na2CO3 и NaНCO3 — титруется раствором HCl с фенолфталеином (ф-ф) и метиловым оранжевым (м. о), применяемыми последовательно. Какое вещество или какая смесь титруется, если объем израсходованной кислоты составляет:
| V HCl/ф-ф | - | |||||||||
| V HCl/ф-ф | - |
35. Навеску 0,3251 г технической гидроокиси натрия растворили в мерной колбе емкостью 100 мл. На титрование 25,00 мл раствора с фенолфталеином израсходовали 18,40 мл 0,1000 н. HCI, а с метиловым оранжевым 18,30 мл кислоты. Вычислить процентное содержание NaOH в образце.
36. На титрование с фенолфталеином навески 0,4478 г. состоящей из Na3CО3, NaHCО3 и NaCl, потребовалось 18,80 мл 0,1998 н. раствора кислоты. При титровании с метиловым оранжевым на ту же навеску израсходовали 40,00 мл раствора кислоты. Вычислить процентное содержание Na2CО3 и NaHCО3 в образце.
37. Навеску 0,4000 г технической гидроокиси натрия растворили в мерной колбе емкостью 100 мл. На титрование 20,00 ил раствора с метиловым оранжевым израсходовали 19,20 мл раствора НCI (Т(НCI)=0,003600). Такую же пробу раствора обработали 2 и. BаCl2 до полноты осаждения карбонатов и при титровании с фенолфталеином израсходовали 18,80 мл раствора HCI. Определить процентное содержание карбонатных примесей в препарате.
38. Навеску 2,000 г суперфосфата поместили в сухую мерную колбу емкостью 100 мл. Объем раствора довели ацетоном до метки. 50,00 мл фильтрата разбавили втрое водой, прибавили несколько капель метилового красного и оттитровали 15,00 мл 0,1020 н. КОН до желтой окраски. Затем прибавили фенолфталеин и оттитровали до розовой окраски, затратив 7,00 мл раствора КОН. Вычислить процентное содержание H2SO4 n H3PО4 в суперфосфате.
39. Постройте кривые титрования:
а) 0.2000 М раствора соляной кислоты 0.1000 М раствором гидроксида натрия;
б) 0.1000 М раствора муравьиной кислоты 0.1000 М раствором гидроксида натрия;
в) 0.1000 М раствора маннитборной кислоты 0.1000 М раствором гидроксида натрия;
г) 0.1000 М раствора фосфорной кислоты 0.1000 М раствором гидроксида натрия;
д) 0.1000 М раствора гидрокарбоната натрия 0.1000 М раствором соляной кислоты;
е) 0.05000 М раствора тетрабората натрия 0.10000 М раствором соляной кислоты;
ж) 0.0100 М раствора гидрофосфата натрия 0.0100 М раствором соляной кислоты;
з) 0.1000 М раствора карбоната натрия 0.1000 М раствором соляной кислоты;
и) 0.1000 М раствора уксусной кислоты 0.1000 М раствором гидроксида натрия;
к) 0.0100 М раствора гидрофосфата натрия 0.0100 М раствором гидроксида натрия;
Для каждого из указанных в задаче веществ подберите такой индикатор, чтобы погрешность титрования не превышала 1%.
40. Рассчитать индикаторную ошибку титрования 0,1 н. NаОН 0.1 и. раствором НСl с тимолфталенном (рТ = 10).
41. Вычислить индикаторную ошибку титрования 0,2 н. НCl 0,2 и. раствором NaOH с метиловым красным (рТ = 5).
