Метод полуреакций в уравнении окислительно-восстановительных реакций
Окислительно-восстановительные реакции в неорганическом синтезе.
Общие положения теории ОВР.
В общем виде процесс выражается схемой:
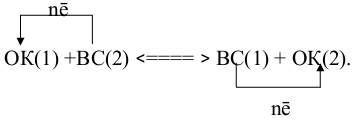
В реакции участвуют две сопряжённые окислительно-восстановительные пары: одна состоит из исходного окислителя ОК(1), и его восстановленной формы, ВС(1); другая –из исходного восстановителя, ВС(2), и его окисленной формы, ОК(2).
О механизме окислительно-восстановительных реакций:
Принятая модель переноса электронов не является строгой и чаще всего не соответствует реальному механизму реакции, но очень удобна для определения изменения степеней окисления,
для нахождения стехиометрических коэффициентов и, главное, для интерпретации природы ОВР с позиций учения об электродных потенциалах.
Перенос одного или двух электронов, как правило, одностадийный процесс. Есть работы, в которых указывается, что двухэлектронный перенос осуществляется в две стадии по одному
электрону и тогда этот случай ничем не отличается от одноэлектронного переноса. Перенос более двух электронов –многостадийный процесс и очень сложный. Считается, что перенос электронов осуществляется через образование активного комплекса, как в реакции:
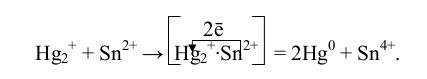
в результате чего образуются устойчивые продукты реакции (Hg0 и Sn4+).
Иногда перенос электронов связан с переносом атомов, как в реакции:
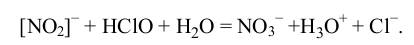
Сначала образуется активированный комплекс [NO2−∙HClO], в котором кратковременная неустойчивая связь N…..O превращается в стабильную с одновременным разрывом связей O-H и O-Cl в молекуле хлорноватистой кислоты:
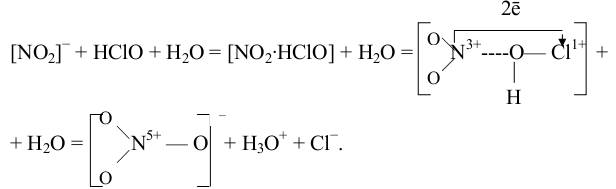
В активированном комплексе присоединение атома кислорода вызывает перенос двух электронов от атома азота по мостику N….O-Cl к атому хлора.
О направлении окислительно-восстановительных реакций:
В теории окислительно-восстановительных реакций главными являются следующие вопросы:
–возможен или невозможен тот или иной окислительно-восстановительный процесс в конкретной химической системе;
–если такой процесс возможен, то насколько глубоко (обратимо или практически необратимо) он протекает, т.е. какова константа равновесия окислительно-восстановительной реакции.
К решению этих двух вопросов можно подходить на той же самой универсальной основе, на которой
обычно обсуждается природа любой химической реакции в химической термодинамике: найти для нее изменение энтальпии ∆Н, изменение энтропии∆S, задать температуруТи определить изменение свободной энергии Гиббса; затем по значению ∆G и по ее знаку сделать необходимые выводы о возможности рассматриваемого процесса и о его константе равновесия при заданной
температуре. В случае окислительно-восстановительных реакций в водных растворах эта процедура существенно упрощается, если использовать ставшую традиционной модифицированную схему, в основе которой лежит понятие окислительно-восстановительного, или электродного, потенциала (φ). Изменение свободной энергии ∆G в окислительно-восстановительном процессе в целом может быть передано разностью электродных потенциалов окислителя и восстановителя (∆E= φ ок – φ вс):∆G= –nF∆E, где F–постоянная Фарадея; n–число электронов, которыми "обмениваются" окислитель и восстановитель. Иначе можно сказать, если φок > φвс в объединенном процессе, т.е. ∆E>0 (при этом ∆G<0), то такой процесс следует признать возможным в данных условиях. Поскольку константа равновесия (К) связана с изменением свободной энергии (∆G)соотношением ∆G= –RTlnK, где R–универсальная газовая постоянная;Т–температура реакции, то соотношение между ∆Е и константой равновесия ОВР
очевидно:
ΔE=(RT/nF)lnK
Отсюда следует, что чем больше разность электродных потенциалов окислителя и восстановителя, тем больше константа равновесия окислительно-восстановительного процесса.
Таким образом, переходя на "язык" электродных потенциалов, следует сделать следующие выводы:
–окислительно-восстановительный процесс возможен, если ∆Е>0 (при этом ∆G<0);
–окислительно-восстановительный процесспротекает тем глубже, то есть с большей константой равновесия, чем больше по своему значению разность ∆E;
–процесс невозможенпри ∆Е <0 (∆G>0).
Для очень большого числа окислительно-восстановительных полуреакцийопределеныстандартные электродные потенциалы и сведены в справочные таблицы.
Стандартные значения (φ0) получены при концентрациях 1моль/дм3 для всех участников полуреакции, при температуре 298К, парциальном давлении газообразных компонентов
1∙105Па, концентрации гидратированных ионов водорода в растворе 1моль/дм3
(рН =0). По значению стандартных электродных потенциалов можно предвидеть возможность протекания той или иной реакции в стандартных условиях.
Электродный потенциал изменяется при отклонении условий (температуры или концентрации) от стандартных. Его значение можно определить по уравнению Нернста:
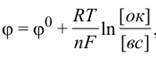
где [ок] –произведение концентраций компонентов окисленной
формы в соответствующих степенях;[вс] –произведение концентраций компонентов восстановленной формы также в соответствующих степенях.
Возможность же осуществления окислительновосстановительного процесса определится неравенством φ ок> φ вс, так как при этом ∆G<0. Необходимо принять во внимание, что все полученные выводы основаны на термодинамическом подходе и поэтому указывают лишь на принципиальную осуществимость того или иного окислительно-восстановительного процесса.
Реальность его будет определяться действием кинетических факторов, что необходимо учитывать при рассмотрении конкретной окислительно-восстановительной реакции.
Безусловно, запрещенность ОВР в термодинамическом аспекте безоговорочно означает его реальную неосуществимость. Но в тех случаях, когда окислительно-восстановительная реакция
оказывается возможна с точки зрения электродных потенциалов составляющих ее полуреакций, вопрос о том, протекает ли такой процесс в действительности или не протекает, решают с учетом
кинетических факторов.
Метод полуреакций в уравнении окислительно-восстановительных реакций.
Метод полуреакций или метод ионно-электронного баланса применяют при составлении уравнений сложных реакций, протекающих в водных растворах или расплавах. Стехиометрические коэффициенты находят при составлении схемы полуреакций для процессов окисления и восстановления. Напомню, что в методе электронного баланса записываются только атомы, которые меняют свои степени окисления. Для составления записи в методе полуреакций используют реальные частицы – атомы, молекулы, ионы, а также частицы, характеризующие среду (кислую – Н+, щелочную – ОН-, нейтральную – H2O). Сильные электролиты записывают в виде ионов, а слабые электролиты, газообразные вещества и труднорастворимые соединения – в виде молекул.
При нахождении коэффициентов в уравнении реакции руководствуются правилами:
- Если исходные вещества содержат большее число атомов кислорода, чем полученные продукты, то освобождающийся кислород в кислой среде с ионами водорода образует воду, а в нейтральной и щелочной средах с молекулами воды – гидроксид-ионы:
Кислая рН < 7:
Общая схема: O2- + 2H+ = H2O
Примеры: MnO4- + 8H+ +5e = Mn2+ + 4H2O
Cr2О72- + 14H+ + 6e = 2Cr3+ + 7H2О
Нейтральная рН = 7, щелочная рН > 7:
Общая схема: O2- + H2O = 2OH-
Примеры: MnO4- +2H2O+3e = MnO2 + 4OH-
CrO42-+4H2O +3e =[Cr(OH)6]3- + 2ОН-
- Если исходные вещества содержат меньшее число атомов кислорода, чем образующиеся, то недостающее число атомов кислорода восполняется в кислой и нейтральной средах за счет молекул воды, а в щелочной – за счет ионов ОН- :
Кислая рН < 7, нейтральная рН = 7:
SO32– + H2O – 2e = SO42– + 2H+
SO2 + 2H2O – 2e = SO42– + 4H+
Cr3++ 8OH-– 3e = CrO42-+ 4H2O
Щелочная рН > 7:
SO32– + 2OH- – 2e = SO42– + H2O
SO2 + 4OH- – 2e = SO42– + 2H2O
AsO2- + 4OH- – 2e = AsO43– + 2H2O
Пример: брала отсюда (http://chemyfly.ru/?p=534)
Составьте уравнение реакции Na2SO3 + KMnO4 + H2SO4 → с помощью метода полуреакций (ионно-электронного метода).
Решение: Для составления уравнения реакции воспользуемся следующим алгоритмом:
1. Определим вещество, которое является окислителем и восстановителем. Сульфит натрия в растворе образует ион SO32–, в котором атом серы находится в промежуточной степени окисления +4. Перманганат калия образует ион MnO4-, в котором марганец находится в своей высшей степени окисления +7. Поэтому SO32– – восстановитель, а MnO4- – окислитель, H2SO4 (точнее ионы Н+)- средообразователь.
2. Составим полуреакцию процесса восстановления, учитывая, что в кислой среде ион MnO4- восстанавливается окисляется до Mn2+:
MnO4- + H+ → Mn2+
Избыточный кислород содержащийся в MnO4-связывается ионами водорода с образованием молекулы воды. Чтобы связать 4 атома кислорода, потребуется 8 ионов H+ и в результате образуется 4 молекулы H2O.
MnO4- + 8H+ → Mn2+ + 4H2O
Не забудьте проверить, соответствует ли число атомов каждого элемента (Mn, H, O) в правой части числу атомов каждого элемента в левой части полуреакции.
Для определения числа электронов, участвующих в процессе восстановления, вычислим сумму зарядов в левой и правой части полуреакции. Сумма в левой части равна (-1) + 8·(+1) = +7, а в правой +2. Уравняем число зарядов прибавляя 5 электронов к левой части. Стрелку заменим знаком равенства:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O
3. По аналогии с полуреакцией восстановления, составим полуреакцию процесса окисления, учитывая, что сульфит-ион окисляется до сульфата:
SO32– → SO42–
Недостающее число атомов кислорода в анионе SO32– пополняется в кислой среде за счет молекул H2O, при этом высвобождаются ионы водорода:
SO32– + H2O→ SO42– + 2H+
Числа атомов каждого элемента (S, O, H) в левой и правой частях уравнения полуреакции становятся равными.
Сумма зарядов в левой части (-2) – (-1) = -1, в правой (-2)+2=0. Поэтому из левой части вычитаем 2 электрона:
SO32– + H2O – 2e = SO42– + 2H+
4. Суммируем обе полуреакции:
MnO4- + 8H+ +5e = Mn2+ + 4H2O 2
SO32– + H2O – 2e = SO42– + 2H+ 5
_______________________________________________________
2MnO4- + 16H+ + 5SO32– + 5H2O → 2Mn2+ + 8H2O + 5SO42– + 10H+
Сокращая одинаковые молекулы или ионы, получаем:
2MnO4- + 6H+ + 5SO32– → 2Mn2+ + 3H2O + 5SO42–
Из ионно-молекулярного составляем уравнение в молекулярной форме присоединяя те ионы, которые присутствовали в исходных реагентах:
2MnO4- + 6H+ + 5SO32– → 2Mn2+ + 3H2O + 5SO42–
2К+ 3SO42- 10Na+ 2SO42- 10Na+ 2К+
2KMnO4 КMnO4+ 3H2SO4 + 5Na2SO3 = 2MnSO4 + 3H2O + 5Na2SO4 + K2SO4
