Регуляция водно-электролитного обмена
Поддержание осмотического гомеостаза на уровне организма осуществляется с помощью нейроэндокринной регуляции на всех этапах водно-электролитного обмена: поступления воды в организм, перемещения ее из одного сектора в другой и выделения из организма.
Осмотическая регуляция. Поступление воды в организм обеспечивается изменением питьевого поведения, которое зависит от чувства жажды. Последнее возникает при потере воды, равной 0,5% от массы тела.
Жажда является субъективным ощущением, возникающим в норме при недостатке в организме воды и проявляющимся сухостью слизистой полости рта и глотки, вызывающей дискомфорт. При значительной степени водного дефицита чувство жажды становится мучительным, по силе и непреодолимости уступая лишь ощущению недостатка воздуха или боли. Это ощущение связано с деятельностью центра жажды.
Центр жажды составляют нейроны ряда областей головного мозга — образований, окружающих 3-й желудочек (циркумвентрикулярные, или перижелудочковые, органы), преоптической зоны и гипоталамуса. Их особенностью является наличие больших вакуолей, заполненных жидкостью с определенной осмоляльностью — 300 мосм/кг Н2О.
Центральные высокочувствительные осморецепторы, непосредственно улавливающие изменения осмоляльности, широко представлены в разных областях мозга, из которых наибольшее внимание привлекли латеральная преоптическая зона и область латерального гипоталамуса. Периферические осморецепторы имеются в различных тканях и, воспринимая сдвиги осмоляльности, посылают афферентные сигналы в центр жажды. Однако сигналы от периферических рецепторов не являются необходимыми для возникновения чувства жажды в ответ на физиологические смещения степени гидратации. Главную роль в формировании чувства жажды играют центральные осморецепторы, осуществляющие прямой и постоянный контроль за изменением степени осмоляльности и тем самым водно-электролитного баланса в головном мозгу.
Нейроны циркумвентрикулярных органов центра жажды — субфорникального и сосудистого органа концевой пластинки — чувствительны к АТ-II, регулятору физиологического приема воды (в меньшей степени к АТ-III), и к ПНУФ. Их аксоны проецируются на крупноклеточные ядра гипоталамуса, преоптическую область и переднюю часть 3-го желудочка, что обеспечивает влияние на освобождение АДГ и прием воды.
В гипоталамусе и преоптической зоне находятся нейроны, воспринимающие орофарингеальные и зрительные сигналы в процессе приема воды. Те же нейроны могут воспринимать сигналы противоположного значения, т. е. обусловленные изменениями осмотического гомеостаза. Возбуждение центра жажды устраняется при мнимом питье, давлении на барорецепторы желудка, что нашло применение в клинической практике: например, полоскание рта водой для ослабления чувства жажды у тяжелых больных.
Таким образом, в формировании жажды принимают участие различные системы гипоталамических нейронов, интегрирующие сенсорные влияния, обусловленные видом и вкусом воды, с внутренними сигналами, идущими от осморецепторов, локализованных в перижелудочковой, преоптической зонах и в гипоталамусе. Система сравнения, расположенная около нейронов супраоптического ядра, может контролировать их активность и таким образом оказывать влияние на высвобождение АДГ (рис. 3).
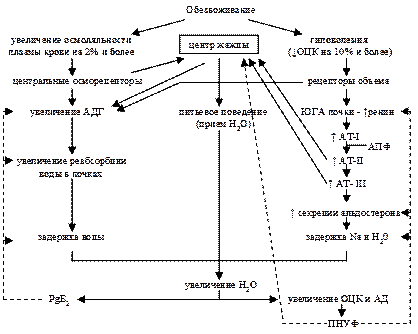
Рис. 3. Основные механизмы регуляции осмотического гомеостаза. Примечание: сплошные линии — активирующие влияния; пунктирные линии — тормозящие влияния (отрицательная обратная связь)
Волюмическая регуляция — важнейший механизм сохранения водно-электролитного баланса — также участвует в формировании жажды. Волюморецепторы предсердий, устьев полых вен и легочной вены и барорецепторы каротидного синуса и дуги аорты реагируют соответственно на изменения объема и давления циркулирующей крови.
В реализации осмо- и волюморефлексов — основных инструментов регуляции осмотического гомеостаза — участвуют гуморальные механизмы.
Гуморальная регуляция водно-электролитного обмена осуществляется гормонами и местнообразующимися физиологическими активными веществами, в частности простагландинами Е. Основными гормонами, регулирующими осмотический гомеостаз, являются вазопрессин (АДГ), гормоны РААС (ангиотензин-II и альдостерон), ПНУФ (атриопептин).
Аргинин-вазопрессин (ВП), или антидиуретический гормон (АДГ), представляет собой нонапептид, образующийся нейроэндокринными нейронами супраоптического (СОЯ), паравентрикулярного (ПВЯ) и ряда добавочных ядер гипоталамуса.
Ген ВП гомологичен у разных млекопитающих и состоит из 3-х экзонов, разделенных 2 интронами. В геноме только одна его копия. Трансляция ВП происходит одновременно с его белком-носителем нейрофизином 2. В комплексе Гольджи осуществляется их упаковка и преобразование в нейросекреторные гранулы. Последние по аксонам ВП-нейронов поступают в терминали, расположенные в нейрогипофизе. Отсюда ВП выделяется в системный кровоток через фенестрированный эндотелий капилляров. ВП инкретируется путем экзоцитоза по Са-зависимому механизму, индуцируемому деполяризацией мембраны.
Активация ВП-нейронов возникает при увеличении осмоляльности плазмы крови на 1–2% и при гиповолемии за счет импульсов от осмо- и волюморецепторов (рис. 3). Чувствительность самих ВП-нейронов к колебаниям ионного состава крови сомнительна.
Факторы, изменяющие секрецию ВП, представлены в табл. 7.
Филогенетически наиболее ранняя функция ВП, сформировавшаяся уже у бесхвостых амфибий, заключается в осмотической регуляции и сохранении воды в организме. Кроме антидиуретического эффекта, ВП обладает широким спектром действия: повышает сосудистый тонус, влияет на систему гемостаза, осуществляет инотропный эффект в отношении желудочков сердца, изменяет поведение, участвует в эндогенном антипирезе и др.
Основной эффект ВП можно свести к эуосмии — поддержанию осмотического давления крови и тем самым межклеточной жидкости, что создает условия для сохранения стабильного объема клеток в организме, определяющего их эффективное функционирование, и установлению соответствия объема циркулирующей крови емкости сосудистого русла.
Главным органом-мишенью для гормонов-регуляторов водно-электролитного обмена являются почки. Основное значение ВП связано с регуляцией конечного этапа реабсорбции воды в почечных канальцах. Антидиуретическое действие реализуется в результате связывания ВП с рецепторами, локализованными на базолатеральной части внешней мембраны эпителиоцитов собирательных трубок. Согласно современным представлениям, в базолатеральной мембране находятся V2- и V1- рецепторы вазопрессина. V2-рецепторы являются тригерами (запускают процесс), а V1-рецепторы модулируют действие V2-рецепторов (препятствуют чрезмерной реакции). Рецепторы ВП имеются и на апикальной плазматической мембране, т. е. обращены в сторону просвета канальца. При действии агониста на эти рецепторы меняется реакция клеток на одновременную стимуляцию V2-рецепторов базолатеральных участков клеточных мембран.
Таблица 7. Стимуляторы и ингибиторы секреции вазопрессина
| Стимулируют секрецию | Тормозят секрецию |
| — повышение осмоляльности плазмы крови — уменьшение артериального давления — гиповолемия — стресс — боль — тошнота и рвота — АТ—II — ацетилхолин — никотин — барбитураты | — уменьшение осмоляльности плазмы крови — повышение артериального давления — гиперволемия — холод — этиловый спирт — глюкокортикостероиды |
Эффекты стимуляции различных типов ВП-рецепторов представлены в табл. 8.
V2- и V1-рецепторы ВП относятся к семейству рецепторов, ассоциированных с G-белками. Связывание ВП с V2-рецептором приводит к активации АЦазы, нарастанию концентрации цАМФ в клетке собирательной трубки, активации под ее влиянием ПК-А и усилению специализированной функции данной клетки: активации транспортных элементов цитоскелета (микротрубочек и микрофиламентов); фосфорилированию и встраиванию в апикальную часть плазматической мембраны белка водных каналов аквапорина-2 (АП-2), что увеличивает ее проницаемость для воды и всасывание последней по осмотическому градиенту в кровь. Белок АП-2 находится в апикальных пузырьках, которые при действии ВП с помощью микротрубочек и микрофиламентов транспортируются к апикальной мембране, сливаются с ней, что и обеспечивает встраивание АП-2 в мембрану.
В базолатеральных мембранах основных клеток собирательных трубок содержатся также белки водных каналов АП-3 и АП-4, совместное функционирование которых обеспечивает высокую водную проницаемость этих мембран.
Уровень экспрессии всех 3-х аквапоринов регулируется ВП (долговременная регуляция). Кратковременная регуляция свойственна только АП-2, который изменяет свою локализацию под влиянием ВП, тогда как АП-3 и АП-4 встраиваются в плазматическую мембрану независимо от гормонального стимула.
Таблица 8. Типы ВП-рецепторов и эффекты их стимуляции
| Органы клетки мишени | Типы ВП-рецепторов | Эффекты стимуляции |
| Почки: 1) эпителиоциты собирательных трубок; 2) толстый восходящий отдел петли Генле | V2 V1 V2 | Повышение реабсорбции воды; модуляция эффекта ВП Повышение реабсорбции ионов Na, Ca, Mg, K |
| Сосуды: 1) ГМК; 2) эндотелиоциты | V1 V2 | Вазоконстрикция, повышение АД; экспрессия фактора фон Виллебранда |
| Гипофиз | V1 | Освобождение АКТГ |
| Печень | V2 | Повышение гликогенолиза, гликолиза, гликонеогенеза; антикетогенное действие; освобождение фактора VIII свертывания крови |
| Кишечник: ГМК | V1 | Сокращение |
| Тромбоциты | V2 | Повышение адгезии, агрегации, тромбогенез |
| ЦНС | Активирует стресс; поведенческие реакции; усиливает тревожность, память; снижает реакцию на боль |
Примечание: Механизмы клеточной сигнализации при действии ВП преимущественно на V2-рецепторы включают стимуляцию аденилатциклазного пути (увеличение цАМФ, протеинкиназ); преимущественно на V1-рецепторы — фосфоинозитидного пути (3-ФИФ, ДАГ, Са). В обоих случаях внутриклеточными посредниками выступают также Са-кальмодулин и образованные простагландины
АП-2 — единственный водный канал, определяющий развитие некоторых форм патологии. Например, мутации человеческого гена АП-2 вызывают нефрогенный несахарный диабет. У ВП-дефицитной линии крыс Brattleboro (центральный несахарный диабет) наблюдается снижение экспрессии белка АП-2. При введении им экзогенного ВП количество АП-2 в апикальных мембранах клеток собирательных трубок значительно увеличивается. При застойной сердечной недостаточности, напротив, экспрессия АП-2 усиливается, что приводит к повышению реабсорбции воды в собирательных трубках и задержке ее в организме.
В высокопроницаемом эпителии проксимальных канальцев и нисходящего сегмента петли Генле нефрона у млекопитающих (крыс, кроликов) имеется АП-1, участвующий в трансцеллюлярном перемещении воды в этих отделах почки. Мутации гена АП-1 не сопровождаются клиническими нарушениями.
При активации V1-рецепторов ВП-м в качестве клеточного посредника выступает не цАМФ, а инозиттрифосфат, диацилглицерин, ионы Са. В клетках почечных канальцев они снижают эффект ВП, т. е. уменьшают транспорт ионов и воды.
Роль гиалуронидазы в механизме действия АДГ в почке — увеличении проницаемости клеточной мембраны для воды (А. Г. Гинецинский, 1958) до настоящего времени остается окончательно не установленной, исследования в этом направлении продолжаются.
Таким образом, ВП увеличивает проницаемость для воды клеток связующего отдела нефрона и собирательных трубок; в клетках толстого восходящего отдела петли Генле повышает реабсорбцию ионов Na, Ca, Mg; в клетках собирательных трубок коркового вещества почки стимулирует транспорт ионов Cl, а в клетках собирательных трубок наружного мозгового вещества почки усиливает реабсорбцию мочевины.
Кроме того, ВП влияет на клубочковую фильтрацию вследствие повышения тонуса сосудов и сокращения клеток мезангия. Это приводит к уменьшению поверхности капилляров клубочков и снижает коэффициент гломерулярной ультрафильтрации. Таким образом, все эффекты ВП направлены на обеспечение максимальной реабсорбции осмотически свободной воды и осмотическое концентрирование мочи.
Снижение секреции ВП лежит в основе синдрома несахарного диабета (рис. 4),характеризующегося полиурией (до 20 л в сутки и более), низкой плотностью мочи и полидипсией.
Дефицит АДГ или снижение его эффективности описаны при ночном энурезе, которым страдают от 15 до 28% детей. Механизм его связывают с инвертированным ритмом секреции ВП: в отличие от нормы, секреция АДГ ночью не увеличивается, а напротив, снижается, что и обуславливает в итоге повышение ночного диуреза.
Недавно выявлены и другие варианты патогенеза ночного энуреза, связанные с изменением эффекта АДГ под влиянием простагландинов.
Повышение секреции вазопрессина.Синдром неадекватной секреции АДГ зависит от резкого повышения в крови уровня АДГ, что ведет к увеличению реабсорбции воды в почке и снижению осмоляльности крови ниже 280 мосм/кг H2О — гипоосмии. Несмотря на наличие гипонатриемии, моча у больных концентрируется. В большинстве случаев речь идет о нарушении осмотической регуляции секреции ВП.
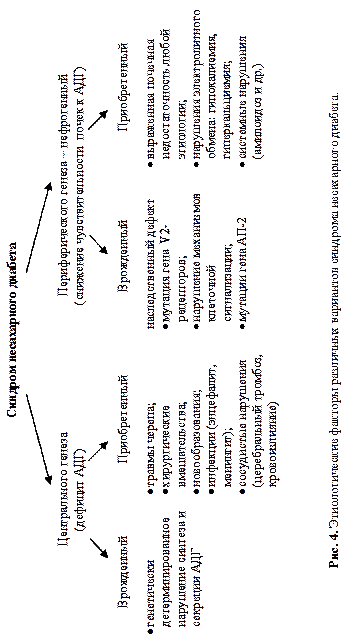
Этот синдром возникает при различных патологических состояниях, которые можно отнести к следующим категориям: опухоли и метастазы опухолей ряда органов, например, опухоли мозга; заболевания легких (туберкулез, астма, пневмония) и поражения ЦНС (менингит, энцефалит, тромбоз мозговых сосудов и др.). В клинике важно дифференцировать этот синдром от состояний, сопровождающихся гипоосмией, — психогенной полидипсии, водной интоксикации, гипокортицизма. Отличительной чертой синдрома неадекватной секреции АДГ будет выделение больным осмотически концентрированной мочи (вследствие действия АДГ на почки), тогда как для первичной полидипсии характерен повышенный диурез с низкой осмоляльностью мочи (вследствие приема большого количества воды и вызванного этим снижением секреции АДГ).
Ренин-ангиотензин-альдостероновой системе принадлежит ведущая роль в регуляции осмотического давления, объема циркулирующей крови и сосудистого тонуса.
Начальное звено системы — образованиеренина — связано с юкстагломерулярным аппаратом (ЮГА) почек. Последний включает ренинпродуцирующие клетки, расположенные в стенке участка афферентной артериолы, прилегающего к плотному пятну (в меньшей степени — в стенке эфферентной артериолы), и само плотное пятно (macula densa) — специализированный начальный сегмент дистальных извитых канальцев почек.
В гранулярных юкстагломерулярных (ЮГ) клетках ренин продуцируется в форме проренина, который вследствие протеолиза образует активную форму ренина с молекулярной массой 42000 дальтон, поступающую в кровоток. Подобные ренину ферменты, изоренины, образуются и в других тканях — головном мозгу, матке, сердце, подчелюстных слюнных железах, корковом слое надпочечников, стенках крупных сосудов. Однако их роль несопоставима с таковой почечного ренина. Об этом свидетельствует тот факт, что после двухсторонней нефрэктомии уровень ренина плазмы крови резко снижается или даже становится неопределимым.
Скорость секреции ренина почками контролируется рядом механизмов.
1. Барорецепторами афферентной артериолы клубочка, реагирующими на изменение в ней перфузионного давления. Так, падение в приносящей артериоле давления ниже 100 мм рт. ст. вызывает быстрый рост продукции ренина, и, наоборот, повышение перфузионного давления вызывает растяжение стенок приносящей артериолы, что тормозит секрецию ренина. Сигнал передается ЮГ-клеткам паракринно, или они сами воспринимают его, выступая в роли барорецепторов.
2. Изменением в первичной моче содержания хлорида и Na+ на уровне плотного пятна. Отклонения в составе указанных ингредиентов, например, их увеличение, приводит к усилению реабсорбции их через стенку канальца в области плотного пятна, которое служит сигналом для торможения секреции ренина. Напротив, снижение уровня NaCl в дистальном канальце и его реабсорбции вызывает повышение секреции ренина. Указанные изменения состава первичной мочи воспринимаются плотным пятном, что вызывает изменение продукции ренина ЮГ-клетками по паракринному механизму.
3. Влиянием симпатических нервов почек, усиливающих секрецию ренина путем прямого воздействия норадреналина на β1-адренорецепторы ренинпродуцирующих клеток. Катехоламины могут модулировать секрецию ренина за счет изменения перфузионного давления в сосудах клубочков: увеличивать при действии на β-адренорецепторы афферентной артериолы (вазодилатация) или снижать при опосредованной α-адренорецепторами вазоконстрикции афферентных и эфферентных сосудов.
4. Модулирующим секрецию ренина действием простагландинов. Почечные простагландины, особенно ПГ Е2 и ПГ И2 (простациклин), могут стимулировать секрецию ренина. Надо отметить, что они не являются обязательными внутриклеточными регуляторами синтеза и секреции ренина, т. к. сильная стимуляция ЮГ-клеток другими факторами (резкое падение перфузионного давления в почках, геморрагическая гипотензия, острый дефицит Na, β-адренергическая стимуляция) может вызвать секрецию ренина даже на фоне торможения ЦОГазы, т. е. синтеза ПГ.
Тем не менее, торможение синтеза простагландинов индаметацином сокращает прирост активного ренина плазмы, наблюдаемый при гипокалиемии, а также у больных с синдромом Бартера, в патогенезе которого очень важна роль повышенной продукции почечных простагландинов, стимулирующих гиперплазию ренинпродуцирующих клеток.
5. Угнетающее влияние на секрецию ренина оказывают АТ-II (прямое влияние на ЮГ-клетки по механизму обратной связи), соматостатин и АДГ.
В крови активный ренин взаимодействует со своим субстратом ангиотензиногеном. Это синтезируемый печенью гликопротеид молекулярной массой 57 кД, находящийся в α2-глобулиновой фракции белков плазмы крови. Ренин отщепляет от него декапептид ангиотензин-I (АТ-I), биологически неактивный прогормон. Под воздействием АПФ АТ-1 превращается в октапептид АТ-II .
АПФ локализуется в сосудистых эндотелиоцитах и наиболее активен в легочных сосудах, где образуется 50% АТ-II. В плазме крови и в почках образуется ~10–20% АТ-II. Заметим, что АПФ одновременно инактивирует брадикинин, выступая в роли кининазы-II. Таким образом, один и тот же фермент способствует образованию прессорного вещества АТ II и инактивирует депрессорные кинины, тем самым обуславливая регуляцию кровяного давления этими антагонистическими системами (ренин-ангиотензинной и кининовой). В настоящее время в клинической практике широко используются ингибиторы АПФ как эффективные средства против артериальной гипертензии.
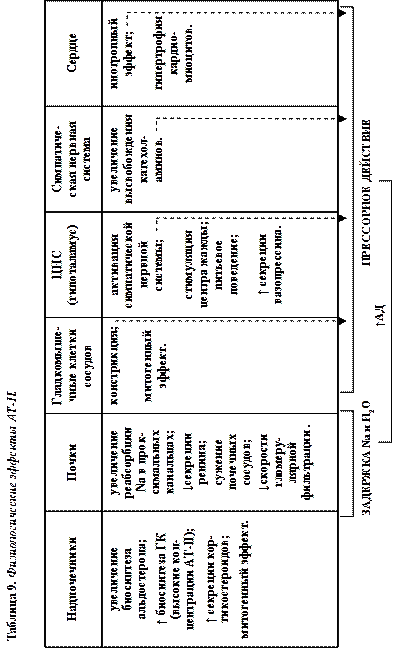
АТ-II — гормон, связывающийся с ассоциированными с G-белками рецепторами двух типов — АТ-1 и АТ-2. Рецепторы первого типа представлены преимущественно в ГМК сосудов, второго типа — в почках, коре надпочечников, головном мозгу. Действие АТ-II в сосудах опосредовано через фосфоинозитидный механизм передачи сигнала с участием Ca и ПК С; в других тканях — путем ингибирования АЦазы и ПК А. Физиологические эффекты АТ-II представлены в табл. 9.
АТ-II элиминируется из крови путем ферментативного гидролиза тканевыми и плазменными ангиотензиназами. При последовательном протеолизе образуется ряд продуктов, из которых АТ-III (гектапептид АТ-II) обладает биологической активностью: стимулирует биосинтез альдостерона в надпочечниках, как и АТ-II; проявляет прессорную активность, составляющую 30–50% активности АТ-II; вызывает чувство жажды. Содержание его у человека достигает 1/5 концентрации АТ-II.
Альдостерон и менее активный дезоксикортикостерон —основные минералокортикоиды, регулирующие калий/натриевый гомеостаз и объем внеклеточной жидкости. Суточная секреция альдостерона у взрослых людей, портребляющих нормальное количество натрия, колеблется от 50 до 250 мкг, а его концентрация в плазме — от 5 до 15 нг% . Период полужизни составляет около 30 минут. Метаболизируется преимущественно в печени, и его метаболит экскретируется из организма в виде конъюгата с глюкуроновой кислотой. Небольшая часть самого альдостерона образует лабильный в кислой среде коньюгат с глюкуроновой кислотой — как в почках, так и в печени, и также экскретируется из организма.
Действие альдостерона в почке направлено на собирательные трубки коркового вещества, где он ослабляет экскрецию Na, увеличивая экскрецию К и иона водорода. Вода пассивно следует за реабсорбированным Na, что вызывает увеличение объема внеклеточной жидкости. Альдостерон и другие минералокортикоиды могут действовать и на другие эпителиальные клетки, в частности желудочно-кишечного тракта и выводных протоков слюнных и потовых желез, также задерживая выведение Na.
Механизм действия альдостерона состоит в связывании со специфическим цитозольным белком-рецептором, что способствует проникновению в ядро клетки. Связанный с ядерным хроматином, он увеличивает транскрипцию специфической мРНК с последующим синтезом специфических белков. Согласно существующим представлениям, эти белки являются факторами Na+-каналов, изменяющими их структуру на люминальной поверхности главных клеток почечного канальца и увеличивающими таким образом проницаемость клеточной мембраны для Na+; повышенное количество Na+ входит в главные клетки и стимулирует активность Na+/К+-АТФазы базолатеральной мембраны. Усиленный транспорт К+ в клетку через базолатеральную мембрану приводит к повышенной секреции К+ в результате выхода его через калиевые каналы в просвет почечных канальцев.
Регуляция секреции альдостерона осуществляется:
1) ренин-ангиотензинной системой;
2) концентрацией K и /или Na в плазме;
3) АКТГ гипофиза
и модифицируется рядом дополнительных факторов (табл. 10).
Таблица 10. Факторы, регулирующие секрецию альдостерона
| Повышают секрецию | Угнетают секрецию |
| — ренин-ангиотензинная система — ↑К, ↓Na — ↑серотонина — стресс — гиповолемия — лихорадка — гипертермия — ↑АКТГ, СТГ | — ↑Na, ↓К — гиперволемия — дофамин |
В отличие от Na, который участвует в регуляции секреции альдостерона главным образом опосредованно (через систему ренин-ангиотензин), и только резкие сдвиги концентрации его в плазме изменяют уровень альдостерона, К действует непосредственно на клубочковую зону коры надпочечников и стимулирует секрецию альдостерона. Последний, в свою очередь, облегчает экскрецию К почками, и эта обратная связь важна для поддержания гомеостаза К. Поэтому достаточно резкие изменения в потреблении К здоровым человеком тотчас же отражаются на секреции альдостерона: низкое потребление К приводит к снижению, а высокое — к повышению секреции гормона. Таким образом, К, подобно ренин-ангиотензинной системе, регулирует секрецию альдостерона по механизму отрицательной обратной связи.
Изменение содержания Na и К в пище влияет на реактивность клеток, продуцирующих альдостерон в надпочечниках ко многим стимуляторам секреции гормона. Так, длительное повышенное потребление К с пищей или ограничение Nа в диете приводит как к усилению секреции альдостерона на острую стимуляцию, так и к увеличению размеров клубочковой зоны коры надпочечников, что имеет большое значение для поддержания гомеостаза K и Nа.
Усиление секреции альдостерона может быть первичным(первичный гиперальдостеронизм) и вторичным. При первичном гиперальдостеронизме (синдром Конна) стимулы к повышенной продукции гомона исходят из самих гормонопродуцирующих клеток, например, при гормонопродуцирующей опухоли надпочечника, гиперплазии ткани надпочечников, эктопической продукции альдостерона клетками АПУД-системы.
При вторичном гиперальдостеронизме гиперсекреция гормона зависит от активации ренин-ангиотензинной системы, например, при артериальной гипертензии, тяжелой острой декомпенсации кровообращения (острая кровопотеря, шок); в случаях снижения внутрисосудистого объема (прием диуретиков, ограничение Nа, внеклеточная дегидратация), когда стимулом для гиперсекреции гормона служит гиповолемия; при гиперплазии ЮГА в почечных клубочках (синдром Бартера); при циррозе печени; в ранней стадии почечной недостаточности вследствие усиления продукции ренина. Независимо от генеза гиперальдостеронизма, для синдрома характерны выраженные сдвиги со стороны электролитов и кислотно-основного равновесия — гипокалиемия, гипернатриемия и гипокалиемический алкалоз.
Уменьшение секреции альдостерона.Первичный изолированный гипоальдостеронизм развивается вследствие нарушения синтеза гормона, например, в случае недостаточности фермента 18-оксистероиддегидрогеназы, участвующего в его образовании.
Гипоальдостеронизм может быть в сочетании с генерализованными повреждениями коры надпочечников, например, при аддисоновой болезни, когда снижается и продукция глюкокортикоидов.
При псевдогипоальдостеронизме почки не чувствительны к альдостерону, в связи с чем уровень гормона в крови обычно повышен.
Катехоламины (КА) оказывают влияние на почечный кровоток через барорецепторы почечных сосудов. Взаимодействуя с α-адренорецепторами приносящих (и выносящих) артериол и с β-адренорецеторами приносящих артериол почечных клубочков, КА вызывают соответственно вазоконстрикцию и вазодилатацию. Кроме того, норадреналин прямо воздействует на β-адренорецепторы ЮГ-клеток, стимулируя секрецию ими ренина, и на β-адренорецепторы стенки дистальных канальцев и собирательных трубок коркового вещества почки, увеличивая их просвет.
Предсердные натрийуретические факторы (ПНУФ), или атриопептины, продуцируются нейроэндокринными клетками предсердий, головного мозга (гипоталамус), вегетативных ганглиев, легких. Продукция их возрастает при гиперволемии, растяжении предсердий, физической и солевой нагрузках, при сердечной и почечной недостаточности.
Участие ПНУФ в волюмо- и осморегуляции тесно связано с действием РААС. ПНУФ подавляют функцию последней, уменьшая секрецию ренина почками и альдостерона надпочечниками, а также тормозят жажду и продукцию АДГ (рис. 2).
Эффекты ПНУФ определяются взаимодействием их со специфическими рецепторами и опосредуются внутриклеточным гуанилатциклазным механизмом и снижением уровня внутриклеточного Са.
Основными органами-мишенями для ПНУФ являются почки, в которых они стимулируют натрийурез и диурез. Экскреция Na осуществляется посредством следующих механизмов:
¾ повышения скорости клубочковой фильтрации путем снижения сопротивления афферентных артериол;
¾ угнетения реабсорбции Na в собирательных трубках мозгового слоя почки, независимо от изменения скорости фильтрации.
Имеются сведения о натрийуретическом факторе под названием уабаин, образующемся в гипоталамусе и поступающем с кровотоком в почки и другие органы. Натрийуретический эффект его связан с угнетением Na+, K+-АТФазы, что нарушает реабсорбцию Na+ в почечных канальцах и увеличивает его экскрецию.
Простагландины (ПГ) —метаболиты арахидоновой кислоты, образуются во всех тканях, в том числе в почках, главным образом в мозговом слое (в 20 раз больше, чем в корковом). Почечные ПГ участвуют в регуляции или модуляции ряда важных физиологических функций (табл. 11).
Продукция простагландинов усиливается при повышении гипертоничности интерстициальной жидкости в мозговом веществе почки. Здесь в собирательных трубках стимуляция ВП-рецепторов апикальной мембраны сопровождается повышением образования ПГЕ2 и ПГЕ1, что в известной мере определяет снижение гидроосмотического эффекта ВП и служит конечным механизмом обратной связи (см. рис. 2).
Таблица 11. Локализация почечных простагландинов и их эффекты
| Локализация в почках | Эффекты простагландинов |
| Корковый слой | Участие в регуляции: — почечного кровотока; — скорости клубочковой фильтрации; — секреции ренина |
| Мозговой слой | Участие в: — модулировании кровотока в прямых сосудах; — реабсорбции Na, хлоридов; — реакции собирательных трубок на вазопрессин; — регуляции восстановления водонепроницаемости клеточных мембран канальцев |
ПГ участвуют в регуляции восстановления водонепроницаемости клеточных мембран собирательных трубок после действия ВП — процессе, связанном с перемещением аквапорина в цитоплазму путем эндоцитоза. Необходимость участия ПГ в этом процессе продемонстрирована опытами с ингибированием их синтеза (вольтареном, индометацином) и ФЛазы А2 (кинокрином), что приостанавливало восстановление водонепроницаемости.
Избыточная локальная продукция ПГ, нарушающая ВП-регуляцию в почке, может стать существенным фактором патогенеза некоторых форм ночного энуреза и других аутокоидозов (Ю. В. Наточин, В. А. Кузнецова, 1997). У части детей с ночным энурезом происходит изменение (снижение) ВП-регулируемой реабсорбции ионов Na и Mg с сопровождающими анионами в толстом восходящем отделе петли Генле под влиянием антагонистического действия избыточно образованного ПГ Е2.
Лечение этих детей десмопрессином (синтетическим аналогом ВП) или вольтареном (ингибитором ПГ-синтетазы), снижающими уровень и эффект действия ПГ Е2, усиливало реабсорбцию Na, Mg и воды и таким образом оказало положительное терапевтическое действие соответственно у 85% и 35% пациентов (Ю. В. Наточин, 2003).
ГЛАВА 4.
НАРУШЕНИЯ ВОДНОГО ОБМЕНА
