Аномальные типы гемоглобина
В крови человека открыто около 150 типов мутантных гемоглобинов. Аномальные гемоглобины различаются по форме, химическому составу, величине заряда. Выделены аномальные гемоглобины при помощи методов электрофореза и хроматографии. Передающиеся по наследству изменения – результат мутации единственного триплета, который приводит к замене одной аминокислоты на другую (с резко отличающимися свойствами – пример серповидноклеточная анемия – глу заменен на вал).
Патология обмена гемоглобина.
Болезни гемоглобинов (их около 200) называют гемоглобинозами.
Гемоглобинозы делят на:
1. Гемоглобинопатии – в основе лежат наследственные изменения структуры какой-либо цепи нормального гемоглобина («молекулярные болезни»).
2. Талассемии – нарушение синтеза какой-либо цепи гемоглобина.
3. Железодефицитные анемии.
Классическим примером наследственной гемоглобинпатии является серповидноклеточная анемия. Глу в 6-м положении в 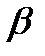 -цепи заменен на вал. Эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. Такой гемоглобин после отдачи кислорода превращается в плохо растворимую форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, которые деформируют клетку и вызывают массивный гемолиз.
-цепи заменен на вал. Эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. Такой гемоглобин после отдачи кислорода превращается в плохо растворимую форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, которые деформируют клетку и вызывают массивный гемолиз.
Талассемии – генетически обусловленной нарушение синтеза одной из нормальных цепей гемоглобина. Угнетение синтеза 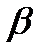 -цепей вызывает развитие
-цепей вызывает развитие 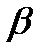 -талассемии, угнетение синтеза
-талассемии, угнетение синтеза 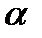 -цепей -
-цепей - 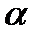 -талассемия. При
-талассемия. При 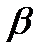 -талассемии появляется до 15% HbA2, повышается до 15-60% содержание фетального гемоглобина. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, деформацией черепа и тяжелой гемолитической анемией. Эритроциты имеют мишеневидную форму. Механизм изменения формы эритроцитов не выяснен. Название связано с тем, что возникает у людей, живущих на побережье Средиземного моря.
-талассемии появляется до 15% HbA2, повышается до 15-60% содержание фетального гемоглобина. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, деформацией черепа и тяжелой гемолитической анемией. Эритроциты имеют мишеневидную форму. Механизм изменения формы эритроцитов не выяснен. Название связано с тем, что возникает у людей, живущих на побережье Средиземного моря.
Порфирии.
Порфирии – группа заболеваний с наследственной предрасположенностью, возникающих в результате блокирования начальных стадий синтеза гема и сопровождающихся увеличением содержащихся порфиринов в организме.
Глицин Сукцинил-КоА
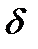 -аминолевуленовая кислота
-аминолевуленовая кислота

порфобилиноген

уропорфириноген

копропорфириноген

протопорфирин IX
 феррохелатаза
феррохелатаза
Гем
Блок – 1 – острая перемеживающая порфирия. Накапливается 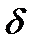 -АМК и порфобилиноген
-АМК и порфобилиноген
Блок – 2 – приводит к накоплению всех предшествующих продуктов. Молекулярный механизм неизвестен.
Болк – 3 – эритропоэтическая протопорфирия связана с отсутствием фермента феррохелатазы, каторая присоединяет к молекуле протопорфирина IX Fe2+.
Распад гема
За сутки в организме распадается около 9 г гемопротеидов. Период жизни эритроцитов 120 дней, разрушаются они в кровеносном русле или в селезенке. Гемоглобин связывается с гаптоглобином и в виде комплекса гаптоглобин-гемоглобин поступает в клетки ретикулоэндотелиальной системы селезенки. Комплекс гаптоглобин-гемоглобин распадается и гаптоглобин переходит в кровь, а гемоглобин окисляется в метгемоглобин (Fe3+).
В РЭС селезенки гемоглобин под действием гемоксигеназы превращается в вердоглобин. Вердоглобин теряет Fe, которое связывается трансферином и доставляется кровью в костный мозг. Вердоглобин отдает белок глобин и превращается в биливердин. При восстановлении биливердина НАДФ Н2 образуется билирубин.
Билирубин – плохо растворимое соединение и в крови связывается с альбумином. В виде комплекса альбумин-билирубин идет транспорт билирубина кровью в клетки печени. В печени билирубин соединяется с глюкуроновой кислотой с образованием моно (20%) и диклюкуронидов (80%), они хорошо растворимы в воде. Этот вид билирубина называется конъюгированным билирубином (связан с глюкуроновой кислотой), а также называется связанным прямым, т.к. может быть прямо обнаружен с помощью реактива Эрлиха.
Билирубинглюкурониды в незначительных количествах диффундируют в кровеносный капилляр. В плазме крови присутствуют 2 формы билирубина: неконъюгированный (непрямой, свободный) и конъюгированный (прямой, связанный) – 25% от общего билирубина. Билирубинглюкурониды с желчью поступают в кишечник, где от них отщепляется глюкуроновая кислота и вновь образуется неконъюгированный билирубин. В тонком кишечнике небольшая часть билирубина может всосаться и через портальную вену вновь поступать в печень. Остальной билирубин подвергается действию кишечных бактерий и в тонком кишечнике билирубин превращается в уробилиноген. Уробилиноген всасывается в тонком кишечнике и через воротную вену поступает в печень, где уробилиноген разрушается до моно- дипирролов.
Не разрушенный уробилиноген вновь с желчью поступает в кишечник и восстанавливается до стеркобилиногена (бесцветен). Стеркобилиноген окисляется до стеркобилина и выделяется с фекалиями. Небольшое количество стеркобилиногена поступает в почки, затем окисляется до стеркобилина и выделяется с мочой.
В норме содержание общего билирубина в сыворотке крови составляется 8-20 мкмоль/л.
Биосинтез гемоглобина
. Posted in Лекции по биохимии
В ретикулоцитах происходит координированный синтез a и b-пептидных цепей гемоглобина, а также синтез его простетической группы, так, что ни один из этих компонентов не образуется в избыточном или недостаточном количествах. Учитывая, что белковая часть молекулы гемоглобина (глобин) синтезируется, как и все остальные белки, далее подробно рассмотрен биосинтез его простетической группы, т.е. синтез тетрапиррольного соединения − гема. Гем, железосодержащее тетрагидропиррольное красящее вещество, является составной частью О2-связывающих белков и различных коферментов оксидоредуктаз. Почти на 85% биосинтез гема происходит в костном мозге, и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма.
К настоящему времени почти полностью выяснены основные пути образования порфиринов и протопорфиринов, являющихся непосредственными предшественниками гема и хлорофилла. Источником всех 4 атомов азота и 8 атомов углерода тетрапиррольного кольца оказался глицин, а источником остальных 26 из 34 атомов углерода − янтарная кислота (сукцинат), точнее ее производное сукцинил-КоА. Последовательность химических реакций синтеза тетрапирролов в организме животных можно условно разделить на несколько стадий.
На I стадии, протекающей в 2 этапа в митохондриях, сукцинил-КоА взаимодействует с глицином и образованием δ-аминолевулиновой кислоты (δ -АЛК).
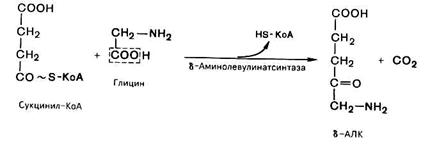
Эту стадию катализирует специфический пиридоксальфосфатзависимый фермент δ –аминолевулинатсинтаза − ключевой, аллостерический фермент синтеза тетрапирролов.
Впервые эта синтаза была обнаружена в эндоплазматической сети клеток печени. Фермент индуцируется стероидами и другими факторами и ингибируется по типу обратной связи конечным продуктом биосинтеза − гемом.
После синтеза δ-аминолевулинат переходит из митохондрий в цитоплазму и на II стадии происходит конденсация 2 молекул δ-аминолевулиновой кислоты с образованием первого монопиррольного соединения − порфобилиногена (ПБГ).
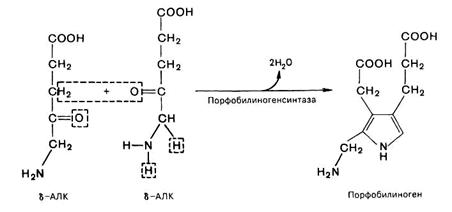
Фермент, катализирующий эту стадию − порфобилиногенсинтаза также является регуляторным ферментом, подвергаясь ингибированию конечными продуктами синтеза. Кроме того, порфобилиногенсинтаза ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината.
В следующей многоступенчатой стадии, катализируемой соответствующими ферментами, из 4 монопиррольных молекул порфобилиногена синтезируется тетра-пиррольный комплекс уропорфириноген, который затем модифицируется в протопорфирин IX, являющийся непосредственным предшественником гема. Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Образующийся копропорфириноген III снова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Модификация боковых цепей заканчивается образованием протопорфириногена IX. На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов.
В заключительной стадии протопорфирин IX присоединяет молекулу железа при участии феррохелатазы (гемсинтазы), и образуется гем (или Fe-протопорфирин IX). Последний используется для биосинтеза всех гемсодержащих хромопротеинов, например включается, в гемоглобин и миоглобин, где он связан нековалентно, или в цитохром С, с которым связывается ковалентно.
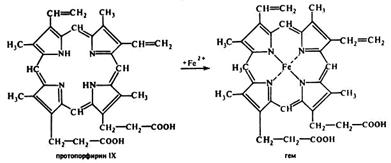
Источником железа для этой реакции является ферритин, который считается резервным гемопротеином, откладывающимся в клетках костного мозга, печени и селезенки.
Имеются указания, что, помимо железа, в синтезе гема участвуют некоторые кофакторы, в частности витамин В12, ионы меди, хотя конкретная их роль не раскрыта.
Таким образом, весь путь синтеза гема может быть представлен в виде схемы, в которой даны полные и сокращенные обозначения промежуточных метаболитов и ферментов.
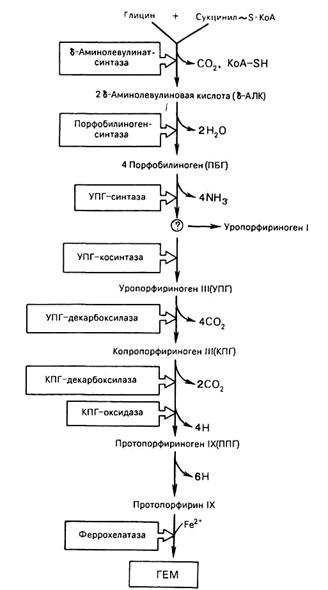
Оба фермента, участвующие в синтезе порфобилиногена из глицина и сукцинил-КоА, являются регулируемыми ферментами; они ингибируются гемом и гемоглобином. С другой стороны, синтез пептидных цепей гемоглобина происходит только в присутствии гема, и образующиеся пептидные цепи тут же соединяются с гемом. При низкой концентрации гема активируется ингибитор инициации белкового синтеза в ретикулоцитах и синтез глобина замедляется. Известны наследственные анемии, связанные с дефектами ферментов, участвующих в синтезе гемма. При этом в организме нередко образуются избыточные количества окрашенных порфиринов − предшественников гема. Такие формы нарушения обмена гемма называют порфириями; некоторые из них протекают очень тяжело. Многие из этих заболеваний приводят к выделению предшественников гема с калом или мочой, которая вследствие этого может быть окрашена в темно-красный цвет. Также наблюдается отложение порфиринов, обладающих фотосенсибилизацией в коже. При воздействии света это приводит к образованию трудноизлечимых волдырей. При порфириях часты также неврологические нарушения. Возможно, что в основе средневековых легенд о людях-вампирах (дракулах) лежит странное поведение больных порфириями (светобоязнь, необычные внешность и поведение, употребление крови в пищу, компенсирующее дефицит гема и зачастую улучшающее состояние при некоторых формах порфирий).
