Темнопольная микроскопия (метод микроскопии в темном поле)
При микроскопии по методу темного поля препарат освещается сбоку косыми пучками лучей, не попадающими в объектив. В объектив микроскопа попадают лишь лучи, отклоненные частицами препарата в результате отражения, преломления или дифракции. В силу этого микробные клетки и другие частицы представляются ярко светящимися на черном фоне.
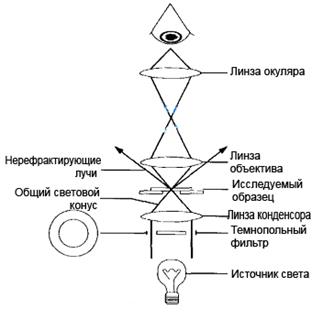 | Ход лучей в темнопольном микроскопе |
Фазовоконтрастная микроскопия.
Обыкновенные окрашенные препараты поглощают часть проходящего через них света, в результате чего амплитуда световых волн снижается и частицы препарата выглядят темнее фона. При прохождении света через неокрашенный препарат амплитуда световых волн не меняется, происходит лишь изменение фазы световых волн, прошедших через частицы препарата. Однако человеческий глаз улавливать это изменение фазы света неспособен, поэтому неокрашенный препарат при правильной установке освещения в микроскопе будет невидим.
Фазоконтрастное устройство позволяет превратить изменение фазы лучей, прошедших через частицы неокрашенного препарата, в изменения амплитуды, воспринимаемые человеческим глазом и, таким образом, позволяет сделать отчетливо видимыми неокрашенные препараты.
Приспособление для фазовоконтрастной микроскопии включает в себя конденсор с набором кольцевых диафрагм, обеспечивающих освещение препарата полным конусом света, и фазовоконтрастные объективы, которые отличаются от обычных тем, что в их главном фокусе располагается полупрозрачная фазовая пластинка в виде кольца, вызывающая сдвиг фазы проходящего через нее света. Установка освещения производится таким образом, чтобы весь свет, прошедший через кольцевидную диафрагму конденсора, прошел в дальнейшем через расположенное в объективе фазовое кольцо.
При рассмотрении препарата весь свет, прошедший через участки препарата, в которых нет каких-либо объектов, пройдет через фазовое кольцо и даст светлое изображение фона. Свет, прошедший через имеющиеся в препарате частицы, например, бактериальные клетки,получит некоторые изменение фазы и, кроме того, разделится на два луча - недифрагированный и дифрагированный. Недифрагированный свет пройдет в дальнейшем через кольцевидную фазовую пластинку в объективе и получит дополнительный сдвиг фазы. Дифрагированные лучи пройдут мимо фазовой пластинки, и их фаза не изменится. В плоскости полевой диафрагмы окуляра произойдет интерференция дифрагированного и недифрагированного лучей. Так как эти лучи идут в разных фазах, произойдет их взаимное частичное гашение и уменьшение амплитуды. Благодаря этому микробные клетки будут выглядеть на светлом фоне темными.
Электронная микроскопия.
Устройство электронного микроскопа.
Возможности световых микроскопов ограничены волновой природой света. При оптимальных условиях световые микроскопы позволяют наблюдать, вследствие явления дифракции, объекты размером не менее 1/2 - 1/3 длины световой волны (около 0,2μ ).
Наибольшими возможностями в смысле разрешающей способности обладают электронные микроскопы, в которых пучок света заменен пучком электронов, длина волны которых составляет 0,04-0,05А.
Принципиальная оптическая схема электронного микроскопа аналогична схеме светового микроскопа, в котором все оптические элементы заменены соответствующими электрическими: источник света заменен источником электронов, стеклянные линзы - линзами электромагнитными, В электронных микроскопах просвечивающего типа различают три системы: электронно-оптическую, электропитания,
Электронно-оптическая система снабжена двумя конденсорными, объективной, промежуточной и проекционной линзами, обеспечивающими увеличение электронного микроскопа от 300 до 200000 крат. Промежуточная и проекционная линзы обеспечивают плавное изменение увеличения при постоянном поле изображения.
Фотографирование изображений при всех видах исследований производится на фотопластинки, фотопленку или фотобумагу.
В комплект электропитания электронного микроскопа входят: шкаф питающего устройства, выпрямитель высоковольтный, пульт управления, щит распределительный, трансформатор высокочастотный, стабилизатор феррорезонансный, соединительные кабели. Устройство обеспечивает электрическое питание всех узлов электронного микроскопа от сети трехфазного переменного тока с напряжением 220 или 380В, частотой 50 гц.
Вакуумная система электронного микроскопа позволяет получать и поддерживать в процессе работы рабочий вакуум 2·10-4 мм рт.ст. в колонне микроскопа, производить шлюзование камеры объекта и фотокамеры. Герметичность вакуумной системы и колонны микроскопа в местах их соединения обеспечивается применением резиновых уплотнителей. Вакуумная система состоит из следующих основных узлов: стояка, вакуумного реле, высоковакуумного клапана, клапана распределительного, комбинированной ловушки, камеры вакуумной, обходного клапана, ловушки предварительного разрежения, диффузионного насоса, вспомогательного диффузионного насоса, баллона предварительного разрежения, механического насоса.
Источником пуска электронов является электронная пушка, состоящая из V -образного вольфрамового термокатода, который при нагревании до 2900° в результате термоэмиссии испускает свободные электроны, ускоряемые затем электростатическим полем, создаваемым между фокусирующим электродом и анодом. Электронный пучок затем формируется с помощью конденсорных линз и направляется на исследуемый объект. Электроны, проходя сквозь объект, за счет его различной толщины и плотности отклоняются под различными углами и попадают в объективную линзу, которая формирует первое увеличенное изображение объекта. После объективной линзы электроны попадают в промежуточную линзу, которая предназначена для плавного изменения увеличения микроскопа и получения диффракции с участков исследуемых образцов. Проекционная линза создает конечное увеличенное изображение объектов, которое направляется на флуоресцирующий экран. Благодаря взаимодействию быстрых электронов с веществом люминофора Флуоресцирующего экрана на нем возникает видимое изображение объекта. Увеличение конечного изображения на экране определяется как произведение увеличений, даваемых объективной, промежуточной и проекционной линзами.
Методы электронно-микроскопического препарирования.
а) Приготовление пленок-подложек и их монтаж на предметные сетки
Электронномикроскопическому изучению могут быть подвергнуты как ультратонкие срезы различных тканей, клеток, микроорганизмов, так и целые бактериальные клетки, вирусы, фаги, а также субклеточные структуры, выделенные при разрушении клеток различными способами.
Для того, чтобы исследовать различные объекты в световом микроскопе, их помещают на предметное стекло. При электронномикроскопических исследованиях роль предметного стекла (оно не может быть использовано, так как непроницаемо для электронов) выполняют очень тонкие, прозрачные пленки-подложки, которые крепятся на опорные сетки.
Обычно для исследований применяют сетки, приготовленные из платины или чистой меди и имеющие до 100 ячеек на I мм2. Они могут быть плетеными или изготавливаются специальным фотохимическим способом. Выпускаются как в готовом виде с внешним диаметром 2 или 3 мм. так и в виде полотна, из которого вырубаются специальными пробойниками.
Толщина пленок-подложек должна быть не более 200А, так как более толстые пленки увеличивают угловое рассеивание электронов, отчего контрастность изображения и разрешение структур объектов значительно уменьшаются. Чаще всего для электронномикроскопи-ческих исследований биологических объектов применяют коллодиевые, формваровые и угольные пленки-подложки.
Благодаря своему заряду электроны слабо проникают через плотные среды. Поэтому объект для исследования должен быть максимально проницаемым для электронов. По этим же соображениям подложка должна быть электрононейтральной, чтобы не задерживать электронов, и бесструктурной, чтобы не затемнять структуру объекта. Кроме того, подложки должны быть прочными, чтобы выдерживать высокую температуру. Для получения пленок-подложек из нитроцеллюлозы пользуются 1,5-2%-ными растворами коллодия в амилацетате (чистый коллодий получают путем выпаривания аптечного эфирного раствора коллодия). Каплю раствора коллодия наносят на поверхность дистиллированной воды, налитую в чашку диаметром около 20 см. Капля быстро растекается по поверхности воды, и после испарения амилацетата образуется тонкая пленка.
Пленки из формвара (поливинилформальдегида) несколько прочнее, чем из коллодия, но получать их сложнее, так как растворители формвара - диоксан, дихлорэтан - не растекаются по поверхности воды, как амилацетат, и, кроме того, очень токсичны. Для получения формваровых пленок чистое, хорошо отшлифованное стекло опускают в раствор 0,1-0,2%-ного формвара в диоксане или дихлорэтане, затем вынимают и подсушивают 5-10 минут на воздухе. На стекле образуется тонкая пленка, которую обрезают по краям стекла, стекло опускают под углом 45° в чашку с водой, пленку осторожно снимают на поверхность воды.
В последнее время все чаще применяют углеродные пленки (они химически инертны, хорошо переносят электронную бомбардировку, термостойки), которые получают путем испарения углерода в вакуумной установке. В установку помещают чистое шлифованное стекло и при контакте двух графитовых стержней, на которые подается электрический ток, на стекло распыляют углерод. Затем тонкую пленку, полученную на поверхности стекла, снимают на поверхность воды, как и в случае снятия формваровой пленки.
После того как на поверхности воды образуется тонкая пленка, полученная одним из вышеописанных способов, на пленку аккуратно пинцетом наносят опорные сетки выпуклой стороной вниз. После этого поверх сеток накладывают листок фильтровальной бумаги и снимают его вместе с пленкой о поверхности воды. Сетки оказываются заключенными между пленкой и фильтровальной бумагой. Бумагу подсушивают, и сетки вместе с подложкой снимают осторожно пинцетом для размещения на них объектов, подлежащих микроскопическому исследованию.
б) Методы негативного и позитивного контрастирования
При рассмотрении объекта в электронном микроскопе и выявлении тонких деталей его строения важны два основных фактора: разрешающая способность микроскопа и контрастность объекта. Ряд биологических структур рассеивают электроны почти так же, как и пленка-подложка, в результате чего контрастность настолько мала, что даже при достаточной разрешающей способности микроскопа изображение объекта не будет различимо. Для увеличения контрастности применяют ряд методов.
Негативное контрастирование. В основе этого метода лежит принцип разности контрастов. При этом исследуемый объект смешивают с раствором соли тяжелого металла и наносят на сетку. Контрастирующее вещество окружает объект более низкой плотности, в результате чего малоконтрастный объект становится отчетливо различим на окружающем его темном фоне. В этом случае получают негативный эффект. Для негативного контрастирования применяют 2%-ный раствор уранилацетата или 2%-ный раствор фосфорновольфрамовой кислоты.
Позитивное контрастирование. Известно, что соли тяжелых металлов могут специфически реагировать с различными биологическими веществами, тем самым они могут повышать контрастность соответствующих структур. Например, осмий хорошо реагирует с липоидными веществами, уранилацетат - с нуклеиновыми кислотами, соли свинца с белковыми компонентами клеток и тканей. Увеличение контрастности структур, возникающее после взаимодействия их с солями тяжелых металлов, обеспечивает позитивное контрастирование объекта, так как в результате "окраски" структуры становятся менее проницаемыми для электронов и выглядят темными на светлом фоне препарата.
в) Метод оттенения
Для увеличения контрастности исследуемых объектов применяют также метод оттенения. При изготовлении образцов по этому методу исследуемый объект помещают в вакуумную напылительную установку и на него под определенными углами производят испарение металла (платины, палладия, золота, хрома, углерода) или их сплавов.
В тех местах, где объект будет экранировать пучок частиц, возникают тени. Рассеивание и поглощение электронов для различных участков объекта оказывается различным, в результате чего контрастность изображения возрастает. Этот метод позволяет не только увеличить контрастность, но и установить в ряде случаев размеры исследуемых объектов по длине тени и углу отклонения с использованием специальных формул.
Методы получения ультратонких срезов
а) Способы фиксации и заливки биологических объектов
Основная цель фиксации - сохранить объект в таком состоянии, которое правильно бы отражало прижизненное состояние объекта. "В настоящее время в практике электронной микроскопии применяют химические способы фиксации. По способу действия на живые структуры все химические фиксаторы разделяют на две группы:
1) фиксаторы, осаждающие (коагулирующие) белки - спирты, уксусная и пикриновая кислоты, соли тяжелых металлов, которые в основном применяют в световой микроскопии;
2) фиксаторы, стабилизирующие липиды - четырехокись осмия, формалин, перманганат калия.
Для фиксации клеток из культур микроорганизмом, выращенных на плотных и жидких средах, применяют 1%-ный раствор KMnO4 приготовленный на ацетат-вероналовом буфере. При фиксации бактериальных клеток по Ритер-Келленбергер применяют стандартный раствор: 1% OsO4 в ацетат-вероналовом буфере (рН=6,0), в котором фиксатором является осмий.
После фиксации производят обезвоживание. В качестве обезвоживающих веществ используют этиловый спирт, метиловый спирт и ацетон, которые берут в возрастающих концентрациях (30°, 50°, 70° , 96°, 100°).
После обезвоживания объекты заключают в пластмассы или другие среды. Так как оптимальная толщина срезов должна быть не более 250-800 А, то необходимо, чтобы заливочный материал обладал определенной твердостью и другими свойствами. Для этих целей используют пластические массы - метакрилаты, эпоксидные смолы.
В практике электронной микроскопии чаще используют метакрилаты: бутилметакрилат и метилметакрилат. Бутилметакрилат полимеризуется в сравнительно мягкие блоки, поэтому к нему прибавляют 10-20% метилметакрилата. В качестве катализатора применяют 1-2%-ную перекись бензоила. Заливочную смесь (рабочую) заливают в желатиновые капсулы, где происходит полимеризация ее при 600 в течение 48 часов.
б) Приготовление стеклянных ножей
Одним из самых важных этапов при получении ультра тонких срезов является процесс приготовления стеклянного ножа. Стеклянные ножи готовят из полос специального (зеркального) стекла, толщина которого должна быть 5 мм. Из такой полосы приготавливают квадраты размером 3x3 см, для чего стеклорезом вначале делают нарезки и по нарезу обламывают клетки-квадраты. Затем приготовленный квадрат надрезают по диагонали и разламывают.
Насечки стеклорезом производят таким образом, чтобы они не доходили до края стекла на 2-3 мм. После разламывания квадрата по диагонали с помощью лупы просматривают получившиеся лезвия. Обычно нож получается несколько неровным и только небольшая его , часть имеет ровный участок, который и используется в качестве лезвия.
Выпускаются специальные приборы - станки для изготовления стеклянных ножей (напр., ССН-1), которые значительно облегчили процесс изготовления ножей. После изготовления ножа на нем укрепляют ванночку из лейкопластыря, и нож с ванночкой устанавливают в микротом.
Демонстрация приготовления стеклянных ножей с помощью прибора ССН-1.
в) Ознакомление с устройством ультрамикротома и получением ультратонких срезов
Незначительная проникающая способность электронов даже при больших ускоряющих -напряжениях требует изготовления сверхтонких срезов. Ультратонкие срезы получают на специальных приборах, называемых ультрамикротомами. В современных микротомах применяется тепловая подача металлического стержня, а через него и блока (объекта) по отношению к ножу. Для подготовки препарата к резанию необходимо, чтобы полушаровидныи конец цилиндрического блока был заточен в виде пирамидки, содержащей объект. Все операции по заточке блока производят под бинокулярной лупой. После подготовки блока к резке его устанавливают в микротом таким образом, что после включения последнего блок начинает двигаться по отношению к неподвижно закрепленному ножу. Получающиеся при микротомии ультратонкие срезы остаются в ванночке ножа, которая предварительно заполняется дистиллированной водой. Срезы свободно плавают на поверхности жидкости. Когда срезов накапливается достаточное количество, их собирают на сетке (прикосновением к поверхности жидкости).
Демонстрация ультратонких срезов бактериальных клеток в электронном микроскопе.
З А Н Я Т И Е2
Дата ______________
Тема: Морфология и ультраструктура бактерий, риккетсий, хламидий, микоплазм, актиномицетов, спирохет, грибов, простейших. Классификация микробов.
План занятия:
1. Спирохеты возвратного тифа. Микроскопия готовых препаратов.
2. Бледная спирохета. Микроскопия готовых препаратов, приготовленных из чистой культуры бледной спирохеты или из исследуемого материала – отделяемого твёрдого шанкра.
3. Лептоспиры. Демонстрация препарата из исследуемого материала с импрегнацией серебром.
4. Актиномицеты: а) микроскопия препарата-мазка из чистой культуры актиномицета; б) демонстрация готового препарата друзы актиномицета.
5. Нитчатые (плесневые) грибы. Макроскопия культур и микроскопия препаратов "раздавленная капля".
6. Дрожжевые грибы. Микроскопия окрашенных препаратов-мазков.
7. Дрожжеподобные грибы рода кандида. Микроскопия культур грибов кандида.
8. Простейшие:
а) микроскопия трипаносом, окрашенных по Романовскому;
б) микроскопия препаратов лейшманий из тканей больного и из чистой культуры.
9. Малярийный плазмодий. Микроскопия препаратов из крови больных малярией: изучение стадий развития плазмодия малярии.
10. Токсоплазмы. Микроскопия готовых препаратов, приготовленных из органов зараженной токсоплазмами белой мыши.
11. Амебы. Микроскопия готовых препаратов-мазков из испражнений больного амёбиазом.
12. Риккетсии. Разбор морфологии по таблицам.
13. Хламидии. Разбор морфологии по таблицам.
14. Микоплазмы. Разбор морфологии по таблицам.
Методические указания
1. Боррелии возвратного тифа в мазке крови больного при окраске по Романовскому-Гимзе на фоне форменных элементов крови выглядят как извилистые фиолетово-сиреневые нити, образующие от 3 до 8 завитков спирали. Завитки неравномерные, глубокие, шаги между завитками разные.
2. Бледная трепонема – возбудитель сифилиса – имеет вид спирали, напоминающей слегка растянутую пружину, имеющую от 6 до 14 завитков. Амплитуда завитков средняя, равномерная, шаг между завитками одинаковый. На концах пружина растянута, как бы, сильнее. При окраске по Романовскому-Гимзе окрашиваются в бледно-розовый цвет.
3. Лептоспиры имеют вид тонкой сильной закрученной пружины, имеют 14-22 витка спирали. Концы часто загнуты в виде крючков (завитки второго порядка), что может им придавать С- или S-образную форму.
4. При микроскопии окрашенных мазков из чистой культуры обратить внимание на сплетение тонких нитей (гифов) и их истинное ветвление. Переплетение гифов – мицелий.
В гистологическом срезе из органа при актиномикозе центральная часть друзы актиномицета представляет сплетение тонких нитей, окрашенных в темно-фиолетовый цвет. Отходящие на периферию концевые нити образуют колбовидные вздутия, окрашенные в розовый цвет.
5. В каплю вода на предметном стекле вносят небольшую частицу гриба и накрывают покровным стеклом. При микроскопии со слабой и сильной сухими системами обратить внимание на строение мицелия и органов плодоношения. Мицелий у мукора одноклеточный, несептированный, а у аспергилла и пеницилла - многоклеточный. Органы плодоношения: большой спорангиеносец с эндоспорами у мукора; конидиеносцы несептированные в виде лейки у аспергилла, септированные в виде кисти рук у пеницилла.
6. В препарате-мазке, окрашенном метиленовым синим, обратить внимание на форму дрожжевых клеток, наличие почковидных выпячиваний, а также на внутреннее строение клеток.
7. Дрожжеподобные грибы рода Candida являются одноклеточными микроорганизмами. Диаметр клеток варьирует в пределах 2-15 мкм. Клетки дрожжеподобных грибов одеты отчетливо заметной оболочкой, имеют цитоплазму, компактное ядро, вакуоли и разнообразные включения. Почкование является единственной формой размножения этих грибов. Форма почек округлая или слегка грушевидная.
Наружных спор типа конидий и внутренних типа аскоспор дрожжеподобные грибы не образуют, чем и отличаются от истинных дрожжей, аскомицетов и конидиальных организмов. Некоторые виды рода Candida образуют хламидоспоры, диаметр их достигает 10-20 мкм, форма округлая, оболочка толстая, двуконтурная. Хламидоспоры возникают на концах псевдомицелия из укрупненных клеток, называемых протохламидоспорами.
Настоящего мицелия дрожжеподобные грибы также не имеют. Образование нитей (филаментация) происходит за счет удлинения клеток и расположения их в длинные цепочки. Такие нити называются псевдомицелием и отличаются от истинного мицелия тем, что не имеют общей оболочки и перегородок, а состоят из длинных клеток, образующихся путем последовательного бокового или концевого почкования.
8. Патогенные простейшие – жгутиконосцы.
8.1. Трипаносомы являются патогенными простейшими, относящимися к типу Sarcomastigophora, имеющими очень характерную морфологию. В мазке крови больного африканской сонной болезнью при окраске по Романовскому-Гимзе имеют размеры 15-30 мкм в длину и 1,4-3,0 мкм в ширину, длина жгутика колеблется от 12 до 42 мкм. Удлиненно-овальное ядро лежит почти в середине клетки, на заднем конце располагается блефаропласт, от которого отходит жгутик. Последний волнообразно изогнут, между ним и телом трипаносомы натянута прозрачная ундулирующая мембрана. От противоположного конца клетки жгутик продолжается на некотором расстоянии свободно.
8.2. Лейшманиальная форма (амастигота, тканевая форма) обнаруживается в патологическом материале в свободных макрофагах или клетках системы мононуклеарных фагоцитов. Амастиготы представляют собой мелкие овальные клетки размером 1-3 × 2-6 мкм с расположенным сбоку овальным ядром и хорошо видимым палочковидной формы кинето-пластом. В просвете кишечника переносчика-москита и в культуре на питательной среде безжгутиковые формы превращаются в подвижные жгутиковые промастиготы (лептомонадная форма). Они имеют веретенообразную вытянутую форму, размеры 4-6 × 10-20 мкм и жгутик, отходящий от кинетопласта. При окраске по Романовскому-Гимзе цитоплазма амастиготы и промастиготы окрашивается в голубой или голубовато-фиолетовый цвет, а ядро, кинетопласт и жгутик – в красный или красно-фиолетовый цвет.
9. В препаратах из крови больных трехдневной малярией найти различные стадии развития малярийного плазмодия: молодые шизонты кольцевидной формы с вакуолью в центре; зрелые шизонты неправильной амебовидной формы без вакуоли; делящиеся шизонты - в стадии меруляции; макфо- и микрогаметоциты правильной овальной формы. Обратить внимание на форму и размеры эритроцитов.
10. Токсоплазмы имеют форму полумесяца или напоминают дольки апельсина. Один конец токсоплазмы заострен, а другой - закруглен. Размеры их следующие: длина 4-7 микронов, ширина – 2-4 мкм. При окраске по методу Романовского-Гимзе цитоплазма токсоплазм окрашивается в голубой цвет; ядро, имеющее вид скопления гранул и сети, - в рубиново-красный цвет. Ядро располагается, как правило, в центре паразита, занимая около 1/4 части его тела.
11. Основной диагностический признак амёбиаза – обнаружение в испражнениях больного цист. Цисты правильной шаровидной формы, иногда слегка вытянуты, диаметр 8-15 мкм. Хорошо заметна бесцветная оболочка. Зрелые цисты содержат 4 ядра, незрелые цисты имеют одно, два, три ядра и вакуоль, содержащую гликоген. В свежем препарате ядра едва заметны; они хорошо выявляются при обработке препарата раствором Люголя.
12. Риккетсии – грамотрицательные прокариоты, не растущие на питательных средах, имеют мелкие размеры, форму палочек, кокковидную, иногда нитевидную. Жизненный цикл риккетсии зависит от жизнедеятельности клетки-хозяина и складывается из 2 стадий — вегетативной и покоящейся. Риккетсии, находящиеся в вегетативной стадии, имеют палочковидную форму, активно размножаются путем бинарного деления и обладают активной подвижностью. Риккетсии покоящейся стадии имеют сферическую форму и не размножаются. Обнаруживаются внутриклеточно окраской по Здродовскому.
13. Хламидии – грамотрицательные прокариоты, облигатные внутриклеточные «энергетические» паразиты. Основные стадии жизненного цикла:
1)элементарные тельца – мелкие (0,2-0,5 мкм) электронно-плотные шаровидные структуры, имеющие компактный нуклеоид и ригидную трехслойную клеточную стенку;
2)инициальные (исходные), или ретикулярные, тельца – большие (0,8-1,5 мкм в диаметре) сферические образования, имеющие сетчатую структуру с тонкой клеточной стенкой и фибриллярным нуклеоидом;
3)промежуточные тельца — промежуточная стадия между элементарными и ретикулярными тельцами.
Вегетативные формы размножаются путем бинарного деления внутриклеточно, но не инфекционны, когда выделяются из клетки-хозяина. Для микроскопического обнаружения хламидии в инфицированных клетках (тканях) применяют различные способы окрашивания: Романовского-Гимзы, Кастенады, Маккиавелло и др. При окрашивании по Романовскому-Гимзе они приобретают голубой или фиолетовый цвет. Однако хламидии хорошо видны и в неокрашенном состоянии при фазовоконтрастной микроскопии влажных препаратов под стеклом.
14. Микоплазмы – мелкие грамотрицательные прокариоты, лишённые клеточной стенки. Морфология их различна – шаровидные, вакуолизированные, нитевидные (нередко ветвящиеся), гранулярные (элементарные тельца) структуры. Обычно неподвижные, но некоторые виды обладают скользящей подвижностью.
  |  |  |
| Боррелии возвратного тифа Borrelia recurrentis | Бледная трепонема Treponema pallidum | Лептоспира Leptospira interrogans |
 |  |  |
| Актиномицет Actinomyces | Друза актиномицета | Нитчатый гриб мукор Mucor |
 |  |  |
| Нитчатый гриб аспергилл Aspergillus | Нитчатый гриб пеницилл Penicillium | Дрожжи Saccharomyces cerevisiae |
 |  |  |
| Грибы кандида Candida albicans | Трипаносома Trypanosoma gambiense | Токсоплазма Toxoplasma gondii |
 |  |  |
| Лейшмании в чист. кул-ре Leishmania tropica | Лейшмании в тканях Leishmania tropica | Патогенная амёба Entamoeba histolytica |
 |  |  |
| Молодой шизонт при | ||
| 3-дневной малярии Plasmodium vivax | 4-дневной малярии Plasmodium malariae | тропической малярии Plasmodium falciparum |
 |  |  |
| Зрелый шизонт при | ||
| 3-дневной малярии Plasmodium vivax | 4-дневной малярии Plasmodium malariae | тропической малярии (не обнаруживается !) Plasmodium falciparum |
 |  |  |
| Стадия меруляции при | ||
| 3-дневной малярии Plasmodium vivax | 4-дневной малярии Plasmodium malariae | тропической малярии Plasmodium falciparum |
 |  |  |
| Гаметоциты при | ||
| 3-дневной малярии Plasmodium vivax | 4-дневной малярии Plasmodium malariae | тропической малярии Plasmodium falciparum |
Контрольные вопросы
Какое место занимают спирохеты в системе микроорганизмов?
Дайте классификацию спирохет.
Какое строение имеют спирохеты?
Какие метода микроскопии применяются для изучения морфологии спирохет?
Какой принцип микроскопии в темном поле?
Какое место занимают актиномицеты в системе микроорганизмов?
Как устроена друза актиномицета?
Каковы особенности морфологии актиномицетов?
Что такое спорангий, гифы, мицелий, конидии?
Чем отличаются мицелий и органы плодоношения мукоровых, аспергилловых и пеницилловых плесеней?
Чем отличаются споры грибов от спор бактерий?
Каковы строение и способы размножения дрожжей?
Каковы морфологические отличия дрожжеподобных грибов от дрожжей?
Что такое аски?
Почему дрожжеподобные грибы относятся к категории несовершенных грибов?
Какие грибы используются как продуценты антибиотиков?
Какова роль дрожжевых и дрожжеподобных грибов в медицине и промышленности?
Что такое хламидоспоры? Псевдомицелий?
У каких грибов имеет место их образование?
Дайте классификацию простейших.
Назовите патогенных представителей из каждого класса простейших.
Какое строение имеют трипаносомы?
Что такое блефаробласт, ундулирующая мембрана?
Какое строение имеют лейшманин?
Чем отличается лептомонадная форма лейшманий от лейшманиальной?
Какова классификация возбудителей малярии?
Какие отличительные признаки имеет комар - переносчик возбудители малярии?
Какие циклы развития имеет малярийный плазмодий?
Как и где протекает спорогония?
Как и где протекает шизогония?
Какова морфологии молодых и зрелых шизонтов, микро- и макро-гаметоцитов и стадии меруляции у возбудителя 3-х дневной малярии?
Каковы отличительные особенности возбудителей 4-дневной и тропической малярии?
Как изменяются эритроциты при различных формах малярии?
Какое строение имеет токсоплазма?
Что такое риккетсии, их морфологические и биологические особенности?
Что такое хламидии, их морфологические и биологические особенности?
Что такое микоплазмы, их морфологические и биологические особенности?
Приложение к ЗАНЯТИЮ 2.
Для дифференциации малярийных плазмодиев необходимо учитывать следующие признаки:
1. Размеры, форма и количество молодых шизонтов;
2. Размеры и форма зрелого шизонта;
3. Количество мерозоитов на стадии меруляции;
4. Размеры поражённых эритроцитов;
5. Морфология половых клеток - гаметоцитов.
При всех формах малярии молодой шизонт имеет форму "голубого перстня с рубиновым камнем". При тропической малярии в одном эритроците может быть иногда 2-3 молодых шизонта одновременно, при остальных формах - только один.
При 3-дневной и тропической малярии зрелый шизонт имеет амёбовидную форму с зернистостью, при 4-дневной - лентовидную форму с узким ядром в виде рубиновой полосы сбоку.
На стадии меруляции при 3-дневной малярии в пораженном эритроците 16-20 мерозоитов, при 4-дневной – 6-8, при тропической – до 30.
Пораженный эритроцит увеличен в диаметре в 1,5-2 раза по сравнению с нормальным только при 3-дневной малярии.
Гаметоциты при 3-х и 4-дневной малярии крупные, занимают почти всю площадь эритроцита, у макрогамет ядро крупнее, у микрогамет – мельче. При тропической малярии гаметоциты имеют серповидную форму.
З А Н Я Т И Е3
Дата ______________
Тема: Микроскопический метод диагностики инфекционных заболеваний. Морфология и ультраструктура микроорганизмов.
План занятия:
1. Знакомство с основными анилиновыми красителями и приготовлением их растворов для окрашивания микроорганизмов.
2. Приготовление препарата-мазка, фиксирование его, окрашивание и микроскопия.
3. Сложные методы окраски микробов. Окраска по Граму с применением контролей и без них.
4. Включения у бактерий. Окраска зерен волютина по Нейссеру и по Лёффлеру.
5. Капсула у бактерий. Окраска капсул в препаратах-мазках из культуры палочки Фридлендера по методу Бурри-Гинса.
6. Споры у бактерий. Исследование спор в неокрашенных препаратах (раздавленная капля) и в препаратах-мазках, окрашенных водным фуксином и по Клейну.
7. Изучение клеточных ультраструктур по электронограммам.
Методические указания
1.Анилиновые красители используются при светлопольной микроскопии для окрашивания микроорганизмов, имеющих клеточное строение, для более качественного наблюдения их морфологии и выявления отдельных субклеточных структур.
В микробиологической практике наиболее часто используются следующие анилиновые красители: I) красные (фуксин основной, фуксин кислый, сафранин, нейтральный красный, конгорот); 2) синие (метиленовый и толуидиновый синие и др.); 3) фиолетовые (генциан фиолетовый, метиловый фиолетовый, кристаллический фиолетовый); 4) желто-коричневые (везувин, хризоидин); 5) зеленые (бриллиантовый зеленый, малахитовый зеленый).
Из перечисленных анилиновых красителей готовят основные насыщенные спиртовые растворы, которые могут храниться длительное время. Для приготовления рабочих растворов основной насыщенный спиртовый раствор красителя разводят дистиллированной водой в соотношении 1:10.
2. На чистое предметное стекло нанести каплю воды. Прокаленной и остуженной петлёй захватить очень небольшое количество микробной массы и коснуться ею капли так, чтобы оставить в ней облачко помутнения. Прокалить и остудить петлю и, перемешав каплю, размазать ее тонким слоем по стеклу, после чего петлю снова прокалить и поставить в штатив.
Подсушить приготовленный мазок на воздухе. Зафиксировать мазок путем проведения нижней стороной через пламя 3-4 раза. Фиксирование считается хорошим, если стекло, приложенное к тыльной поверхности кисти, дает ощущение легкого жжения. При отсутствии такого ощущения препарат может смыться, а при ощущении ожога микроскопическая картина будет искажена.
Положить препарат на мостик для окраски мазком вверх и окрасить нужным методом. После окрашивания тщательно промыть препарат водой и обсушить препарат, аккуратно промокая (но не вытирая!) фильтровальной бумагой. Микроскопировать с иммерсионным объективом. Микроскопическую картину зарисовать в тетрадь.
3. Окраска по Граму (в модификации Синева) производят следующим образом. Из исследуемого материала готовят тонкий препарат-мазок, высушивают его на воздухе и фиксируют на пламени спиртовки.
На препарат кладут кусочек фильтровальной бумаги, пропитанной карболовым раствором генцианвиолета, и увлажняют его 2-3 каплями воды. Окрашивание продолжается 2 мин.
Сбросив пинцетом фильтровальную бумагу, на препарат наливают на 2 мин. раствор Люголя. Слив раствор Люголя, не промывая препарат, наливают на него для обесцвечивания несколько капель 96° спирта на 30 сек (обесцвечивание должно производиться при покачивании стекла).
Быстро смыв спирт водой, препарат докрашивают раствором фуксина Пфейффера в течение 1-2 мин., после чего промывают водой и высушивают.
Для окраски по Граму на одном стекле готовятся три мазка из разных культур (для контроля). Мазок в середине стекла готовят из изучаемой культуры, а по концам стекла с одной стороны - из культуры стафилококка (заведомо грамположительная); а с другой - из культуры кишечной палочки (заведомо грамотрицательная).
Приготовленный таким образом тройной препарат-мазок подсушивают на воздухе, фиксируют на пламени спиртовки и окрашивают как один мазок, чтобы соблюсти одинаковые условия. Лишь при правильной окраске контролей (темно-фиолетовый стафилококк и розовая кишечная палочка) можно считать правильной и окраску среднего мазка, то есть изучаемой культуры.
Из трёх культур приготовить на одном стекле мазки, зафиксировать и окрасить по Граму, промикроскопировать под иммерсией и зарисовать.
 |  |  |
| Окраска по Граму | ||
| Стафилококк Staphylococcus | Исследуемая культура _____________________ | Кишечная палочка Escherichia coli |
4. Окраска зерен волютина
4.1. по Нейссеру:
Фиксированный мазок окрашивают заранее приготовленной уксуснокислой синькой Нейссера 5 мин. Промывают препарат водой и обрабатывают его раствором Люголя в течение I минуты. Не промывая водой, докрашивают препарат везувином 15 сек. Затем промывают, высушивают и микроскопируют. Зерна волютина окрашиваются в темно-фиолетовый цвет, а тело бактерий - в соломенно-желтый цвет.
4.2. по Лёффлеру:
Фиксированный мазок окрашивают щелочным р-ром метиленового синего, который наносят на 3 - 5 мин., после чего смывают водой, мазок высушивают и микроскопируют. Цитоплазма бактерий окрашивается в голубой цвет, волютиновые зерна – в темно-синий или фиолетовый.
5. Окраска капсул по методу Бурри-Гинса.
На предметное стекло нанести каплю туши, внести в нее небольшое количество исследуемой культуры с помощью бактериальной петли, тщательно перемешать. Ребром второго предметного стекла сделать мазок, как для исследования крови. Высушить мазок на воздухе и зафиксировать на пламени спиртовки. Нанести на мазок несколько капель водного фуксина на 2-3 минуты, затем промыть, высушить и промикроскопировать. На фоне туши четко видны окрашенные фуксином бактериальные клетки, окруженные светлым овалом (капсулы). Зарисовать препарат.
6. В препарате "раздавленная капля" споры, обладающие более высоким коэффициентом преломления, выглядят в виде блестящих или темных (в зависимости от фокусировки объектива) образований, отличающихся от более тусклых и неясно очерченных тел бактерий.
При окраске фуксином Пфейффера споры не окрашены и выглядят в виде бесцветных овальных образований, расположенных внутри окрашенных клеток или свободно лежащих между клетками.
 |  |  |
| Зёрна волютина (окраска по Нейссеру) Lactobacterium bifidum | Зёрна волютина (окраска по Лёффлеру) Corynebacterium diphtheriae | Капсулы бактерий (окраска по Бурри-Гинсу) Klebsiella pneumoniae |
 |  |  |
| Споры бактерий у Streptobacillus | ||
| «раздавленная капля» | окраска фуксином | окраска по Клейну |
Для окраски препарата по способу Клейна фиксированный мазок покрывают фильтровальной бумагой, на бумагу наливают карболовый фуксин Циля и подогревают препарат над спиртовкой до появления паров 4-5 раз. Пинцетом снимают бумажку и обесцвечивают препарат, погружая его в стаканчик с 1% -ным раствором серной кислоты на 5-6 сек. Тщательно промывают препарат и дополнительно докрашивают метиленовым синим 3-5 мин. Промывают препарат водой, высушивают и микроскопируют. Споры окрашиваются в красный цвет, вегетативные клетки – в синий. Препараты зарисовать.
7. Демонстрация электронограмм ультратонких срезов различных видов бактерии. Определить на электронограммах клеточную стенку, цитоплазматическую мембрану, мезосомы, рибосомы и нуклеоид (ядерную вакуоль).
Контрольные вопросы
Какие красители - кислые или основные - чаще применяются при окрашивании бактерий и почему?
Какие основные красители красного, синего, фиолетового и коричневого цвета применяются в микробиологии?
Как готовится концентрированный карболовый раствор основного фуксина и насыщенный раствор метиленового синего?
Какие способы окрашивания микробов Вы знаете?
Из каких последовательных этапов складывается приготовление препарата-мазка?
Для чего необходима фиксация препарата-мазка?
Какие способы фиксации препаратов Вы знаете?
Как производится фиксация на пламени и как контролируется ее качество?
Как определить, на какой стороне стекла находится мазок?
В чем заключается принцип окраски по Граму?
В какой цвет окрашены грамположительные бактерии и почему?
Какова методика окраски по Граму?
Как контролируется правильность окраски по Граму?
Почему зерна волютина окрашенные метиленовым синим, получили название метахроматических?
Какие образования составляют оболочку бактерий?
Что представляют собой цитоплазматическая мембрана, клеточная стенка и капсула?
Какие включения могут быть в цитоплазме бактерий?
Какую роль играют капсулы у патогенных бактерий?
По каким признакам можно заподозрить наличие капсул в микробной культуре?
Что такое споры бактерий, каковы их свойства?
Как можно заподозрить наличие опор в микробной культуре?
Каковы принципы окраски капсул у бактерии?
Каковы принципы окрашивания спор у бактерий?
С чем связана высокая терморезистентность спор?
Какова структура пептидогликана?
Каковы функции клеточной стенки бактерий?
Каковы функции цитоплазматической мембраны?
Что такое рибосомы?
Чем отличается ядерный аппарат бактерий от ядерного аппарата эукариотов?
Приложение к ЗАНЯТИЮ 3.
Карболовый фуксин Циля
Основной фуксин 1 г
Спирт 96° 10 мл
Карболовая кислота кристаллическая 5 г
Глицерин несколько капель
Вода дистиллированная до 100 мл
Водный фуксин (фуксин Пфейффера)
Карболовый фуксин Циля 1 мл
Дистиллированная вода 10 мл
