Липопротеины, участвующие в транспорте триглицеридов и холестерина из кишечника в ткани. Их строение, роль апобелков
Липопротеины - это сферические частицы, в которых можно выделить гидрофобную сердцевину, состоящую из триглицеридов (ТРГ) и эфиров холестерина (ЭХС), и амфифильную оболочку, в составе которой – фосфолипиды, гликолипиды и белки.
Белки оболочки называются апобелками. Холестерин (ХС) обычно занимает промежуточное положение между оболочкой и сердцевиной. Компоненты частицы связаны слабыми типами связей и находятся в состоянии постоянной диффузии – способны перемещаться друг относительно друга.
Основная роль липопротеинов – транспорт липидов, поэтому обнаружить их можно в биологических жидкостях.
Липопротеины разделяют по плотности методом ультрацентрифугирования, при этом они не осаждаются, а всплывают (флотируют). Мерой всплывания является константа флотации, обозначаемая Sf. В соответствии с этим показателем различают следующие группы липопротеинов:

Все эти липопротеины отличаются по своей функции.
1. Хиломикроны (ХМ) - образуются в клетках кишечника, их функция: перенос экзогенного жира из кишечника в ткани (в основном - в жировую ткань), а также - транспорт экзогенного холестерина из кишечника в печень.
2. Липопротеины Очень Низкой Плотности (ЛОНП) - образуются в печени, их роль: транспорт эндогенного жира, синтезированного в печени из углеводов, в жировую ткань.
3. Липопротеины Низкой Плотности (ЛНП) - образуются в кровеносном русле из ЛОНП через стадию образования Липопротеинов Промежуточной Плотности (ЛПП). Их роль: транспорт эндогенного холестерина в ткани.
4. Липопротеины Высокой Плотности (ЛВП) - образуются в печени, основная роль - транспорт холестерина из тканей в печень, то есть удаление холестерина из тканей, а дальше холестерин выводится с желчью.
Белковые компоненты липопротеинов особенно важны. Они называются "аполипопротеинами" и обозначаются латинскими буквами (апоА, апоВ, апоС и так до апоG) Функцииапобелков:
1. Апобелки выполняют функцию эмульгаторов, потому что являются амфифильными веществами.
2. Некоторые из аполипопротеинов являются регуляторами активности ферментов липидного обмена.
3. Могут обладать собственной ферментативной активностью.
4.Могут выступать в качестве лигандов клеточных рецепторов для липопротеинов.
5.Многие апобелки осуществляют транспорт липидов из одного липопротеина в другой.
3. Основные этапы синтеза жирных кислот. В каких тканях он наиболее интенсивен? Представить схему челночного транспорта ацетил-КоА из митохондрий в цитоплазму.
Синтез жирных кислот идет в цитоплазме на мембранах эндоплазматического ретикулума путем постепенного удлинения ацетил-КоА на 2 углеродных атома за каждый цикл. Удлинение высших жирных кислот, содержащих более 16 углеродных атомов, идёт путём реакций, обратных b-окислению .
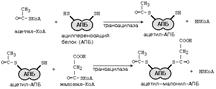

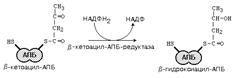
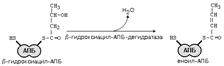
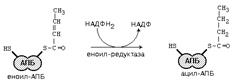
После этого ацил-АПБ вступает в новый цикл синтеза. К свободной SH-группе ацилпереносящего белка присоединяется новая молекула малонил-КоА. Затем происходит отщепление ацильного остатка, и он переносится на малонильный остаток с одновременным декарбоксилированием, и цикл реакций повторяется.
Таким образом, углеводородная цепочка будущей жирной кислоты постепенно растет (за каждый цикл – на два углеродных атома). Это происходит до момента, пока она не удлинится до 16 углеродных атомов (в случае синтеза пальмитиновой кислоты) или более (синтез других жирных кислот). Вслед за этим происходит тиолиз, и образуется в готовом виде активная форма жирной кислоты – ацил-КоА.
Синтез жирных кислот происходит в основном в печени, в меньшей степени – в жировой ткани и лактирующей молочной железе.
Как отмечалось, строительным блоком для синтеза жирных кислот в цитозоле клетки служит ацетил-КоА, который в основном поступает из митохондрий. Было выявлено, что цитрат стимулирует синтез жирных кислот в цитозоле клетки. Известно также, что образующийся в митохондрияхв процессе окислительного декарбоксилирования пирувата и окисления жирных кислот ацетил-КоА не может диффундировать в цитозоль клетки, так как митохондриальная мембрана непроницаема для данного субстрата. Поэтому вначале внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Реакция катализируется ферментом цитрат-синтазой. Образовавшийсяцитрат переносится через мембрану митохондрий в цитозоль при помощи специальной трикарбоксилаттранспортирующей системы.
В цитозоле цитрат реагирует с HS-KoA и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат. Эта реакция катализируется АТФ-цитратлиазой. Уже в цитозоле оксалоацетат при участии цитозольной малатдегидрогеназы восстанавливается до малата. Последний при помощи дикарбокси-латтранспортирующей системы возвращается в митохондриальный матрикс, где окисляется до оксалоацетата, завершая тем самым так называемый челночный цик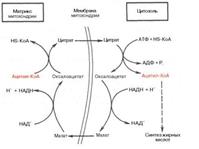
Существует еще один путь переноса внутримитохондриального аце-тил-КоА в цитозоль клетки – с участием карнитина. Как отмечалось, кар-нитин играет роль переносчика ацильных групп из цитозоля в митохондрии при окислении жирных кислот. По-видимому, он может выполнять эту роль и в обратном процессе, т.е. в переносе ацильных радикалов, в том числе ацетильного радикала, из митохондрий в цитозоль клетки. Однако, когда речь идет о синтезе жирных кислот, данный путь переноса ацетил-КоА не является главным.
