Получение культуры микроорганизма в микробиологической лаборатории завода.
Выращивание микроорганизмов в малом посевном аппарате.
Выращивание микроорганизмов в большом посевном аппарате.
Накопление культуры микроорганизмов в малом ферментере.
Передачу чистых культур из одного аппарата в другой осуществляют в конце логарифмической фазы роста. Качество полученного посевного материала контролируют путем микроскопирования.
Иногда для уменьшения опасности заражения инфекцией в инокулятор культуру вносят прямо из пробирок. При этом длительность инокуляции увеличивается.
В производстве антибиотиков часто используют споровый материал. При этом в лабораторных условиях культуру размножают двумя способами:
· культуру продуцента высевают на косой агар, инкубируют до образования спор и смывают их стерильной водой. Суспензию спор снова переносят в свежую агаризированную среду для получения спорового материала второго поколения. Выросшие споры еще раз смывают стерильной водой и суспензию используют для получения первого вегетативного поколения продуцента на жидкой среде;
· культуру продуцента высевают на агаризованную среду для получения спор. Полученную суспензию спор сразу же вносят в колбы с жидкой средой и выращивают их на качалке. Полученный таким образом вегетативный материал продуцента первого поколения используют в качестве посевного материала для второго поколения продуцента в колбах с жидкой средой. Вегетативный материал второго поколения используют для внесения в инокулятор.
. Дальнейшее размножение посевного материала обычно идет в две стадии: в цехе чистой культуры и в отделе инокуляции. Для приготовления посевного материала используют полноценную среду, тщательно проверенную различными химическими и микробиологическими методами. Культивирование микроорганизмов на питательной среде основного состава позволяет культуре быстро адаптироваться к окружающим условиям и компонентам питательной среды, при этом происходит активация ферментов, а также синтезируются новые ферментные системы. Количество питательной среды в аппарате не должно превышать 60 % общего объема Продолжительность приготовления посевного материала на этой стадии обычно не превышает 1 сут. Посевной материал для главной ферментации готовят в количестве 5 – 20 % объема используемой питательной среды.
2)
Ферменты – это катализаторы биологического происхождения. Наиболее ценные свойства ферментов – это высокая активность и специфичность (селективность) действия. Живые организмы содержат сотни и тысячи ферментов, основная функция которых заключается в регуляции практически всех химических реакций, определяющих жизнедеятельность организма.
Для крупномасштабного получения ферментов пригодны только некоторые рас-тительные организмы на определенной фазе их развития (проросшее зерно различных злаков и бобовых, латекс и сок зеленой массы ряда растений), а также отдельные ткани и органы животных (поджелудочная железа, слизистая оболочка желудочно-кишечного тракта, сычуг крупного рогатого скота, семенники половозрелых животных). Практически неограниченный источник ферментов — микроорганизмы (бактерии, грибы, дрожжи), содержащие набор большинства известных в настоящее время энзимов, количество которых можно повысить в десятки и сотни раз методами мутагенеза, селекции и индукции биосинтеза.
Для производства посевного материала используют исходный штамм продуцентов, получаемый из лабораторных чистых культур, который выращивают разными способами на предварительно стерилизованной твердой или жидкой питательной среде до определенного возраста. Посевной материал консервируют (высушиванием или хранением при низких температурах) вплоть до дальнейшего использования. Производственные культуры продуцента получают, выращивая посевной материал микроорганизмов как на поверхности твердых или жидких сред, так и в глубине жидких питательных сред.
Поверхностный метод выращивания продуцентов, предложенный И. Такамине еще в 1894 г., состоит в культивировании микроорганизмов на поверхности увлажненных стерилизованных отрубей, «размещенных в кюветах, к которым иногда добавляют солодовые ростки, древесные опилки, свекловичный жом. Инкубацию микроорганизмов ведут в специальном термостатируемом цехе при постоянном контроле в нем температуры, влажности и подачи воздуха.
В последние 15 лет для выращивания продуцентов ферментов, чаще используют более экономный — глубинный метод культивирования (рис. 1). В промышленных условиях для этих целей применяют ферментеры из нержавеющей стали, снабженные приспособлениями для перемешивания и подачи в жидкую питательную среду стерильного воздуха. Сначала ферментер заполняют питательной средой, автоклавируют, а затем засевают чистой культурой, подаваемой из специального генератора. Для предотвращения инфекции в ферментере поддерживают повышенное давление наряду с оптимальными значениями рН, температуры, редокспотенциала и другими условиями культивирования.наиболее прогрессивным признан проточный метод культивирования микроорганизмов, который обеспечивает непрерывную подачу в ферментер как питательной среды, так и посевного материала. Размножение микроорганизмов и биосинтез фермента регулируют при использовании этого метода по мере поступления питательной смеси в ферментер. Такой ферментер представляет собой вращающийся трубкообразный реактор, через один конец которого в него поступает питательная среда и культура микроорганизмов, а из другого — выводятся ферменты, продукты жизнедеятельности и бактериальная масса. Основное достоинство метода — возможность длительное время поддерживать в автоматическом режиме рост культуры микроорганизма.
Билет 21
1) Питательные среды принято делить на две группы:
1. Среды, требуемые внесения 5-25% природных сывороток (из крови человека или эмбриональных экстрактов крупного рогатого скота)
2. Синтетические питательные среды определенного химического состава.
Назначение питательных сред:
Ø Поддержание оптимальных для роста клеток физико-химических условий
Ø Обеспечение клеток питательными веществами для синтеза биомассы и других продуктов жизнедеятельности
Приготовление питательных сред для ферментационных процессов обычно рассматривается как мало интересная часть общей задачи, но фактически оно является краеугольным камнем, обеспечивающим успех всех последующих этапов. Среды неподходящего состава обусловят низкий уровень ростовых процессов и, следовательно, низкий уровень выхода целевого продукта. Поэтому рассмотрим основные моменты, связанные с этим процессом.
Жидкие компоненты питательных сред (кукурузный экстракт, патоку, мелассу, гидрол, растительные масла, рыбий жир) доставляют на производство в железнодорожных цистернах и хранят в специальных сборниках на складах заводов и транспортируют по коммуникациям с помощью вакуума, сжатого воздуха или перекачивают насосами. Дозировку жидких компонентов осуществляют по массе или по объему в соответствии с прописью среды и контрольными показателями каждой партии этого нестандартного вида сырья.
Сыпучие компоненты сред из транспортной тары забирают или в специальные бункеры или хранят на складах в исходной упаковке. Для транспортировки сыпучих компонентов используют ленточные и винтовые конвейеры, элеваторы, пневматический транспорт.
Жидкие питательные среды приготовляют в аппаратах-смесителях с мешалкой, куда загружают отдельные компоненты в определенной последовательности, установленной по регламенту.
Приготовление сложных комплексных сред, в состав которых, кроме минеральных компонентов и сахаров, входит мука, крахмал, кукурузный экстракт, проводят в нескольких смесителях. Кукурузный экстракт обычно кипятят с мелом для нейтрализации содержащихся в нем аминокислот и органических кислот. Муку, крахмал предварительно заваривают и тщательно перемешивают, чтобы не допустить образования крупных комков, которые могут быть причиной нестерильных операций, поэтому реакторы должны быть снабжены барботерами для подачи пара.
Часто для снижения вязкости питательной среды, содержащей достаточно большую концентрацию кукурузной муки или крахмала проводят их частичный гидролиз амилолитическим ферментом - оризином (продуцент - Aspergillus oryzae) с последующей его инактивавацией нагреванием.
2) Иммобилизованными ферментами называются ферменты, искусственно связанные с нерастворимым носителем, но сохраняющие свои каталитические свойства.
Иммобилизация – физическое разделение биообъекта (клетка, фермент) и растворителя, то есть биообъект закреплен на нерастворимом носителе, а субстрат и продукты свободно обмениваются между биообъектом и растворителем.
Биообъект может работать в этом случае многократно (неделя, месяц). Другими словами можно сказать, что иммобилизация ферментов – это перевод их в нерастворимое состояние с сохранением частичным или полным) каталитической активности.
Преимущества иммобилизации биообъекта:
1. многократность использования ферментов и живых клеток в наиболее продуктивной фазе
2. снижение количества отходов производства
3. повышение качества целевого продукта (он менее загрязнен), более простое выделение целевого продукта (особенно важно для производства инъекционных лекарственных препаратов, когда в продукте мало белка – нет пирогенности и аллергенности).
4. биотехнологический процесс становится более стандартным, более предсказуемым.
5. устойчивость к внешним воздействиям.
Для получения иммобилизованных ферментов обычно применяют следующие методы:
1. Ковалентное присоединение молекул ферментов к водонерастворимому носителю, в качестве которого используют как органические (природные и синтетические) полимеры, так и неорганические материалы. К природным материалам относятся целлюлоза, хитин, агароза, декстраны, бумага, ткани, полистирол, ионообменные смолы и так далее.
2. Захват фермента в сетку геля или полимера.
3. Ковалентная сшивка (сшивание) молекул фермента друг с другом или с инертными белками при помощи би- или полифункционального реагента.
4. Адсорбция фермента на водонерастворимых носителях (часто на ионитах)
5. Микрокапсулирование (захват раствора фермента в полупроницаемые капсулы размером 5-300 миллимикрон).
Такая ситуация приводит к совершенствованию технологических процессов.
В результате иммобилизации ферменты приобретают преимущества гетерогенных катализаторов – их можно удалять из реакционной смеси (и отделять от субстратов и продуктов ферментативной реакции) простой фильтрацией. Кроме того, появляется возможность перевода многих периодических ферментативных процессов на непрерывный режим, используя колонны или проточные аппараты с иммобилизованными
ферментами.
Иммобилизованные ферменты долговечны и в тысячи и десятки тысяч раз стабильнее свободных энзимов. Так, происходящая при температуре 65°С термоинактивация лактатдегидрогеназы, иммобилизованной в 60%-м полиакриламидном геле, замедлена в 3600 раз по сравнению с нативным ферментом. Все перечисленное обеспечивает высокую экономичность, эффективность и конкурентоспособность технологий, использующих иммобилизованные ферменты.
Билет 22
1)
Микроклональное размножение (культура органов растений)
Культуры клеток и тканей для массового размножения растений и оздоровления посадочного материала, в том числе лекарственных растений, нашли широкое применение в растениеводстве. Этот метод, названный микроклональным размножением, позволяет от одной меристемы получить (регенерировать) достаточно большое количество новых растений, в том числе и в культуре in vitro.
Обязательным условием для микроклонального размножения является идентичность полученного растительного материала исходному материнскому растению. Для обеспечения максимальной генетической стабильности клонируемого материала в качестве исходного экспланта используют молодые слабодифференцированные ткани, в частности кончики молодых стеблей и корней, пазушные почки, зародыши, части молодых проростков и другие меристематические ткани. Культуры клеток, полученные из меристематических тканей, дают возможность получить безвирусные клоны. Распределение вирусов в различных частях растения неравномерное, а меристема, как правило, их лишена.
Восстановление целого растения с помощью изолированных культур может происходить разными путями.
Прямая регенерация - это получение растений «в пробирке» непосредственно из верхушечных побегов, пазушных почек и т.д.
Косвенная регенерация - получение целых растений из меристематических тканей, но с промежуточной стадией каллуса. В обоих случаях дифференциация и органогенез управляется фитогормонами. Выросшее в пробирке растение переносится в грунт.
Основное преимущество метода микроклонального размножения, по сравнению с другими классическими методами, - значительно более высокий коэффициент размножения. Если обычным способом (черенками, луковицами, корневищами и т.д.) от одного растения можно получить от 2-3 до 100 растений в год, то методом микроклонального размножения их число можно увеличить от нескольких тысяч до миллиона.
К настоящему времени показана возможность клонировать «в пробирке» около тысячи видов растений. Более чем у ста видов этот метод имеет коммерческое значение. Среди них - декоративные, плодово-ягодные, овощные, древесные, а также некоторые лекарственные растения.
Метод культуры тканей и клеток успешно используется для выведения новых сортов, в том числе и высокопродуктивных лекарственных растений. Для создания нового сорта классическим способом в грунте требовалось 10-30 лет. Благодаря методу культуры тканей этот период можно сократить до нескольких месяцев, поскольку сезонность значения не имеет.
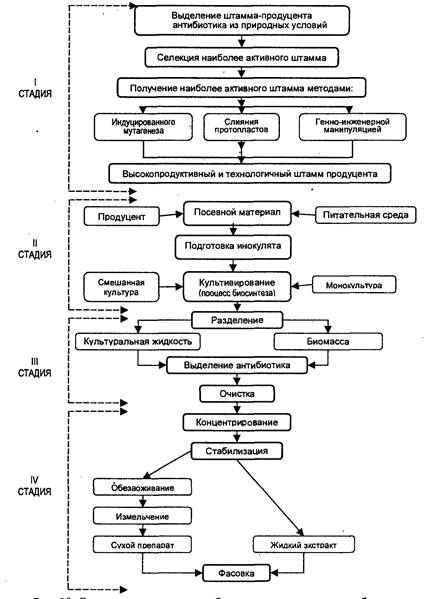
2) 
Билет 23
