Тема 2. МОРФОЛОГИЯ СОВЕРШЕННЫХ И НЕСОВЕРШЕННЫХ ГРИБОВ И АКТИНОМИЦЕТОВ
Контрольные вопросы
1. Представители совершенных и несовершенных грибов, их морфологические особенности.
2. Актиномицеты, их морфология.
3. Методы исследования грибов и актиномицетов.
4. Роль грибов и актиномицетов в сельском хозяйстве.
Оборудование и материалы
Колонии грибов и актиномицетов на агаре и других питательных субстратах, предметные и покровные стекла, препаровальные иглы, спиртовки, микроскопы.
Методические указания
Микробиология изучает грибы, в частности плесневые, которые образуют пушистый налет на различных продуктах питания, плодах, растительных остатках. Грибы принадлежат к различным классам: фикомицеты, сумчатые, несовершенные. Некоторые виды грибов вызывают заразные болезни животных и человека.
Морфологическую особенность грибов и актиномицетов изучают 4 способами:
1. Визуально в чистой культуре;
2. Макроскопически в чашке Петри и на естественных субстратах (рост грибов);
- открывают крышку чашки Петри и ставят ее на предметный столик микроскопа. Рассматривают край колонии гриба в самом тонком месте (х8). Ищут органы спороношения;
- в случае естественной культуры кусочек пораженной ткани с пушком гриба кладут на предметное стекло и рассматривают в микроскоп (х8), который настраивают как для неокрашенного препарата;
3. В микроскопических препаратах (строение гриба и актиномицетов):
- готовят препарат методом раздавленной капли из каждой культуры гриба;
- рассматривают под микроскопом (х8), затем (х40), можно (х90).
Каждый студент по органам спороношения определяет род гриба и делает в тетради зарисовки в специальную таблицу рабочей тетради.
4. Знакомство с грибковыми заболеваниями животных, плодов, овощей по наглядным пособиям.
Признаки плесневых грибов
Плесневые грибы относятся к низшим споровым растениям. Не имеют хлорофилла, не способны к фотосинтезу и хемосинтезу. Грибы очень разнообразны и широко распространены в природе.
Строение тела плесневелых грибов. Тело гриба - грибница, или мицелий, состоит из сплетения тонких переплетающихся нитей, который называются гифами. Мицелий растет на питательном субстрате, образуя на нем пушистый налет. Клетки мицелия гриба состоят из оболочки, протоплазмы, где откладываются запасные вещества одного или нескольких ядер.
Грибы делятся на классы.
1. Архимицеты - мицелия нет или он в зачаточном состоянии.
2.Фикомицеты - мицелий хорошо развит, неклеточного строения. Гифы не имеют перегородок.
3. Аксомицеты, или сумчатые , - мицелий многоклеточный, после полового процесса образуются сумки (аски) со спорами.
4. Базидиомицеты, или базидиальные грибы, - мицелий многоклеточный. Споры образуются на особых органах - базидиях.
5. Несовершенные грибы - мицелий многоклеточный. Половое размножение неизвестно.
Морфологические признаки. Основным является строение органов плодоношения и мицелия. Для приготовления препарата плесневых грибов используют препаровальную иглу, которой захватывают мицелий гриба, а затем осторожно на предметном стекле расщепляют его на мелкие кусочки в капле воды. Наблюдениям мешают обильные споры, поэтому на препарат нужно дать каплю 5%-го раствора уксусной кислоты или этилового спирта, после чего промыть водой. Покрыть покровным стеклом. Плесени сначала рассматривают с объективом (х8). При этом необходимо найти органы размножения. Дальнейшее наблюдение ведут при увеличении в 600 раз.
Краткий ключ для определения плесневых грибов.
1. Мицелий одноклеточный. Споры, споры, которыми гриб размножается, образованы внутри крупных спорангиев, вырастающих на верху ножек (спорангиеносцев).
2. Мицелий стелится по субстрату в виде рыхлого серого налета.
Спорангии крупные, на одинаковых простых или ветвящихся спорангиеносцах. Мукор - Mucor (рис. 1).
Спорангиеносцы ветвящиеся, окрашены в темно - бурый цвет, растут из одного центра кустиками.
У основания кустиков имеются корневидные отростки - гифризоиды. Плесень быстро распространяется по субстрату с помощью стелящихся гиф, напоминающих "усы" клубники. Ризоцус - Rhizopus (рис. 2).
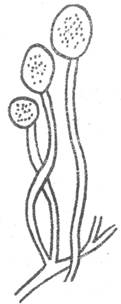
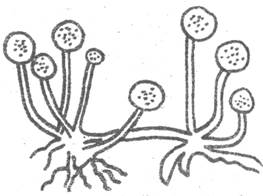
Рис.1. Мукор (Mucor) Рис. 2. Ризопус (Rhizopus)
3.Сильно разветвленный белый многоклеточный мицелий. Гифы легко распадаются на оидии - крупные прямоугольные или круглые толстостенные бесцветные клетки. Конидиеносцев нет совсем или их мало, ничем не отличаются от обычных гиф. на верхнем конце конидиеносцы отшнуровывают овальные, круглые конидии (споры), располагающиеся цепочкой. Оидиум - Oidium (рис. 3). Гифы не распадаются на оидии.
4. Гифы размножаются конидиями, образующимися снаружи на простых конидиеносцах.
Конидиеносцы разветвленные или конидии (споры) образуются прямо на мицелии.
5. Конидиеносцы многоклеточные, прямостоящие, наверху разветвляющиеся, отчего напоминают кисть руки (отсюда название кистевка). Каждую долю кисти заканчивает плодоносящая клетка (стеригма), отшнуровывающая цепочки спор (конидий). Кистевик - Penicillum (рис. 4).
Конидиеносцы одноклеточные.
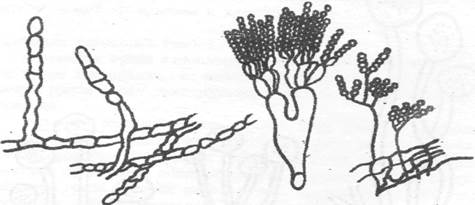
Рис. 3. Оидиум (Oidium) Рис. 4. Кистеник (Penicillum)
6. Конидиеносцы наверху расширяются в виде шаровидной головки, несущей на всей поверхности палочковидные выросты - стеригмы, отшнуровывающие на своих свободных концах цепочки конидий, которые расположены по радиусам и напоминают струи воды из лейки (отсюда название леечная плесень). Конидии и конидиеносцы светло-зеленые.
Леечник зеленый - Aspergillus glaucum (рис. 5).
Конидии орашены в черный цвет.
Леечник черный - Aspergillus niger.
7.Конидиеносцы короткие.
Конидиеносцы длинные.
8. Беловато-розовые или красного цвета волокнистые колонии. Конидиеносцы короткие, разветвленные или их совсем нет. В этом случае конидии образуются прямо на мицелии. Конидии серповидно изогнутые с 1-5 поперечными перегородками. Фузариум - Fusarium (рис. 6).

Рис. 5. Леечник зеленый Рис. 6. Фузариум (Fusarium)
(Aspergillus glaucum)
Колонии темные, коричневые, черные, волокнистые.
9.Конидиеносцы короткие, слабо развитые. Конидии темные, вытянутой формы, расположены цепочками с 3-6 поперечными и с одной или несколькими продольными перегородками.
Альтернария - Alternaria (рис. 7).
Конидиеносцы короткие, пучками.
Конидии одиночные, крупные, яйцевидной или булавидной формы, покрытые часто мелкими щетинками с 3-5 поперечными и продольными перегородками.
Макроспориум - Macrosporium (рис. 8).
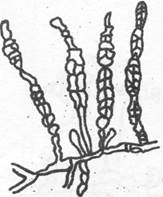

Рис. 7. Альтернария Рис. 8. Макроспориум
(Alternaria) (Macrosporium)
10. Конидиеносцы слабоветвистые, несущие на концах часто 2-клеточные яйцевидные или цилиндрического оливкового или коричневого цвета конидии. Иногда они мелко щетинистые. Часто конидии расположены цепочками.
Кладоспориум - Cladosporium (рис. 9).
Колонии оливково-серые, войлочные.
Конидиеносцы древовидно-ветвистые, несущие на концах ветвей большое количество одноклеточных яйцевидных или округлых бесцветных конидий на коротких нитевидных стеригмах, расположенных группами.
Ботритис - Botritis (рис. 10).
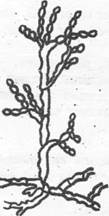

Рис. 9. Кладоспориум Рис. 10. Ботритис
(Cladosporium) (Botritis)
Тема 3. КУЛЬТИВИРОВАНИЕ МИКРООРГАНИЗМОВ
Контрольные вопросы
1. Понятие стерилизации, ее методы.
2. Типы питательных сред, требования к ним.
3. Использование методов стерилизации и культивирования микробов в производстве.
Оборудование
1. Жидкие и плотные питательные среды.
2. Пипетки, бумага, вата, марля, нитки, пробирки.
Методические указания
Изучение различных свойств микробов можно производить только в условиях, когда микробы могут расти, размножаться и проявлять свою жизнедеятельность. Этого достигают при культивировании, т.е. выращивании, микробов на соответствующих питательных средах. Для роста микробов на питательной среде необходимо наличие 10 химических элементов: углерод, водород, кислород, азот, зольные - фосфор, сера, калий, магний, железо, кальций. Кроме того, микробам нужны микроэлементы и витамины. Питательная среда должна быть влажной, иметь оптимальную реакцию среды (для бактерий -нейтральную, слабощелочную, для плесеней и дрожжей - слабокислую, актиномицетов - нейтральную). Они должны быть стерильны и прозрачны. Питательные среды подразделяются на:
естественные (овощи, фрукты, молоко, отвары), которые более полноценны;
искусственные - отвары с добавление "сахаров", пептона, солей;
синтетические (растворы химических веществ).
Все среды подразделяют на жидкие и плотные, обычные - пригодные для культивирования большинства микробов, и специальные, употребляемые для выращивания и выделения тех или иных микробов, которые плохо растут на обычных средах. Дифференциально-диагностические среды применяют в процессе определения вида выделенной культуры, при изучении ее биохимических свойств. Элективные, т.е. избирательные, среды пригодны для выращивания определенного вида микроба из субстрата, богатого другими микроорганизмами. Самые распространенные питательные среды: мясо-пептонный бульон (МПБ) и мясо-пептонный агар (МПА). Основой для их приготовления служит мясная вода, которую готовят следующим образом. Мясо крупного рогатого скота или лошади очищают от жира и сухожилий, пропускают через мясорубку и заливают двойным количеством воды. Через сутки настаивания в прохладном месте отжимают мясо через марлю, доливают водой до первоначального объема и стерилизуют. Для получения мясо-пептонного бульона к мясной воде добавляют 1% пептона и 0,5% поваренной соли. Затем среду кипятят, фильтруют, определяют рН и доводят 10%-м раствором Na2CO3 реакцию среды до требуемой, стерилизуют и используют для работы. Чтобы получить мясо-пептонный агар, в кипящий мясо-пептонный бульон добавляют 2-3% агара, предварительно замоченного в воде. Затем среду кипятят, фильтруют и стерилизуют. Если расплавленный МПА налить в пробирку 1/3 объема и остудить его в наклонном положении, то получается "скошенный" или "косой" агар.
Стерилизация - полное уничтожение или удаление микроорганизмов и их спор в том или ином субстрате. Соблюдение стерильности является важнейшим условием культивирования микробов (слово "стерилизация" произошло от sterilis - бесплодный).
В микробиологической практике прибегают к стерилизации питательных сред, бактериологической посуды, инструментария. В каждом отдельном случае избирают такой способ стерилизации, который, давая надежный результат в смысле уничтожения всех микробов, не изменял бы в то же время свойств стерилизуемого предмета, не нарушал химического состава жидкостей, питательных сред и т.д. В микробиологической практике самым распространенным, удобным и надежным способом стерилизации является применение высокой температуры.
1. Кипячение применяют для стерилизации игл, шприцов и других мелких инструментов. Их кипятят в течении 30 - 45 мин с добавлением 1% соды. При наличие в стерилизуемом материале спор продолжительность кипячения увеличивают до одного часа.
2. Прокаливанием на огне (пламя спиртовки, газовой горелки) стерилизуют бактериологические петли, иглы, пинцеты.
3. Стерилизацию сухим жаром производят в сухожаровом шкафу, или печи Пастера. Это жестяной шкаф с двойными стенками, снаружи покрыт асбестом или другим материалом, не отдающим тепло, на дне его находится электронагревательный прибор или газовая горелка. Сверху через отверстие в крышке вставлен спускающийся внутрь аппарата термометр, который служит для контроля за температурой. Стерилизация длится один час при 1600С и 30 мин при 165 - 1700С начиная с момента, когда ртуть в термометре достигает этой температуры. Обеспложиванию в печи Пастера подвергают всю стеклянную посуду, градуированные и пастеровские пипетки. Инструменты при такой стерилизации тупятся, питательные среды сгорают.
4. Стерилизацию паром проводят при температуре 100 - 120 0С. Существует два способа:
- Стерилизация текучим паром в паровом аппарате Коха. Это жестяной цилиндр с двойной стенкой, сверху покрыт конической крышкой с отверстием для термометра. Для уменьшения отдачи температуры аппарат снаружи покрыт асбестом или другим материалом не отдающим тепло. Внутрь аппарата вставляют ведерко, дно и стенки которого снабжены отверстиями. В двойное дно аппарата наливают воду, ставят в ведерко предметы, подлежащие стерилизации, и подогревают до температуры 1000С. Нагревание при такой температуре длиться 50 - 60 мин. Но однократная стерилизация не всегда обеспечивает полное обеспложивание.
Надежнее стерилизация паром дробная - 3 дня подряд по 20 - 30 мин. Исходят при этом из следующих соображений: так как при 1000С погибают только вегетативные формы, а споры могут оставаться, питательные среды после первой стерилизации оставляют при комнатной температуре до следующего дня. Споры за это время прорастают и при втором нагревании погибают. То же происходит и в третий раз. В этом аппарате стерилизуют только питательные среды, которые выдерживают нагревание до 1000С (желатин, молоко, среды с углеводами);
- Стерилизация паром при давлении в автоклаве типа Палинова котла - самый эффективный способ стерилизации, обеспечивающий полное и надежное обеспложивание. Аппарат состоит из массивного цилиндра, обитого листовым железом, который герметически закрывается металлической крышкой. Автоклав имеет насколько отверстий: для манометра, предохранительного клапана, выпускного крана, для пара. Внутри первого котла имеется другой, меньшего объема. Между ними наливают воду, внутрь автоклава ставят стерилизуемый материал, крышку завинчивают герметически, кран для спуска крана оставляют открытым, воду подогревают. По мере нагревания вместе с паром будет выходить воздух из котла. Когда температура внутри котла достигнет 1000С, из крана станет бить пар. Кран завинчивают, когда пар сухой, что свидетельствует о том, что из котла вышел весь воздух. Теперь образующийся пар не выходит наружу, а поступает в замкнутое пространство, повышается давление и температура. Давление пара замеряют в атмосферах. Определенному давлению будет соответствовать определенная температура, например 3 атмосферы - 1440С, 2 - 133, 1 - 120, 0,2 - 105,20С.
Когда манометр покажет нужную высоту давления, а следовательно и температуру, выдерживают заданное время (15 - 60 мин) и прекращают нагревание. Когда стрелка манометра упадет до 00С, спускают пар, и только тогда автоклав можно открывать. Таким образом стерилизуют питательные среды (за исключением тех, которые не переносят высокой температуры), посуду, инструменты, обезвреживают инфицированный материал. В производственных условиях стерилизуют баночные консервы.
5. Тиндализация - дробная стерилизация при не высокой температуре - 50 - 900С по 30 мин через 24 часа в течении 5 - 7 дней подряд. Предложена для объектов, не переносящих температуру более 80 - 900С. Можно проводить на водяной бане.
6. Пастеризация - одномоментный прогрев при 60 - 700С или более (80 - 980С), введена Пастером для уничтожения бесспоровых микробов в пищевых продуктах (вино, пиво, молоко).
7. Механическая или холодная стерилизация. Целый ряд объектов не может подвергаться стерилизации ни высокой температурой, ни воздействием на них химических веществ, так как с этим связана их денатурация (например, сыворотки). В этих случаях используют метод фильтрования с помощью бактериальных фильтров. Изготавливают фильтры с такими мелкими порами, что они не пропускают бактерий (последние задерживаются на фильтре), а вытекающая после фильтрации жидкость становится стерильной. Фильтры готовят из мелко пористых веществ (инфузорий земли, каолина, асбеста). их изготовляют в виде цилиндрических свечек (Беркефальда - из инфузорий земли и Шамберлана - фарфоровые) или асбестовых пластинок (фильтр Зейтца). Фильтрование производят под повышенным давлением, вследствие чего жидкость нагнетается через поры фильтра в приемник, или же создают разрежение в приемнике, и тогда жидкость всасывается в него через фильтр, поэтому к фильтрующему прибору присоединяют нагнетающий или разрежающий насос. Перед фильтрацией весь прибор должен быть простерилизован в автоклаве под давлением 1 атмосф. 45 мин.
Подготовка посуды для стерилизации. Перед стерилизацией всю стеклянную посуду промывают теплой водой с мылом с помощью ерша или щетки, ополаскивают 2-3 раза водой, высушивают и заворачивают в бумагу. Сухие пробирки, флаконы закрывают ватными тампонами, а горлышки их сверху обвязывают бумажными колпачками.
Ватные пробки готовят следующим образом: кладут на стол продолговатую полоску ваты, загибают внутрь два края, чтобы получилась ленточка, равная по ширине длине пробирки, и скатывают валик по диаметру колбы или пробирки. Затем обвертывают кусочком марли в один слой и края марли снаружи над пробкой связывают нитками. Пробирки стерилизуют в бумажных пакетах по 10-15 штук. Бактериологические чашки завертывают в бумагу по 1-2 штуки, пипетки по 1-5, причем в верхний конец пипетки вкладывают кусочек ваты для предохранения загрязнения во время насасывания ртом жидкости в пипетку. Вату и марлю стерилизуют в маленьких бумажных пакетах.
Методы культивирования микробов. В повседневной лабораторной практике пересев или перевивка чистых культур бактерий или других микроорганизмов является наиболее частой манипуляцией Основное и непременное условие при посеве сохранение чистоты культуры, т.е. только одного вида микробов в пробирке без загрязнения посторонними. Чаще всего применяют посев а пробирку с косым агаром, который производят следующим образом:
- пробирку с чистой культурой на косом агаре берут в левую руку в наклонно-горизонтальном положении между большим и указательным пальцами. Скошенная поверхность агара должна быть повернута к глазам. Рядом с этой пробиркой точно в таком же положении взять пробирку с незасеянной средой. Взяв в правую руку бактериологическую петлю, как писчее перо, прокаливают петлю, держа ее вертикально в пламени горелки до красного каления, затем быстро проводят через пламя 2-3 раза отрезок петледержателя;
- мизинцем правой руки плотно захватывают наружные концы ватных пробок и вынимают их из пробирок. Можно держать пробки в левой руке, поместив одну из них между безымянным и средним пальцами, а вторую между средним и указательным пальцами;
- обжигают края пробирок на пламени спиртовки;
- вводят петлю в пробирку с культурой, остудив ее прикосновением к агару или стеклу, забирают петлей культуру;
- быстро переносят петлю с взятым материалом в пробирку с питательной средой, не задевая краев и стенок обеих пробирок, опускают петлю до конденсационной воды, делают посев по всей поверхности агара прямой чертой;
- вынимают петлю из пробирки. Быстро обжигают края пробки и внутренние концы пробирок и быстро вставляют их в пробирки;
- тщательно прокаливают петлю на пламени и ставят в штатив;
- на засеянной пробирке делают соответствующие надписи (название посеянного микроба и дату посева) и помещают в термостат.
Посевы на жидкие среды. Техника в основном такая же, что и при посеве на твердые среды. Важно при этом следить за тем, чтобы при посеве питательная среда не выливалась из пробирок. Через 24 - 48 выращивания проводят изучение посевов в бульоне и в пересеве на косой агар.
Изучение на косом агаре проводят следующим образом: на пробирках с косым агаром получен рост микроорганизмов в виде налета по штриху. Из него приготовляют обычным образом мазок, окрашивают по Граму, изучают морфологию выросших микробов. Из пробирок с бульоном приготовляют также мазки. Чтобы захватить стерилизованной петлей содержимое пробирки, необходимо предварительно встряхнуть его и распределить тонким слоем по стеклу. В дальнейшем обработка мазка идет так же, как и в первом случае.
