Методы получения дисперсных систем
ВВЕДЕНИЕ
Предлагаемое учебное пособие содержит описание 7 лабораторных работ по основным разделам курса коллоидной химии.
Каждая работа состоит из теоретической и практической частей. В первой части изложены основы соответствующего раздела курса коллоидной химии, что позволит студентам сознательно и успешно выполнить лабораторные работы. Далее следует практическая часть, где описаны цель работы, необходимые реактивы и оборудование, методика ее выполнения и обработки экспериментальных результатов, требования к отчету и вопросы для самоконтроля.
Основные цели лабораторных работ по коллоидной химии – привить студентам навыки самостоятельной экспериментальной работы и помочь усвоению основного теоретического материала, рассматриваемого на лекциях.
ЛАБОРАТОРНАЯ РАБОТА №1
ПОЛУЧЕНИЕ ЗОЛЕЙ МЕТОДОМ ЗАМЕНЫ РАСТВОРИТЕЛЯ.
ИЗУЧЕНИЕ ЯВЛЕНИЯ НЕПРАВИЛЬНЫХ РЯДОВ.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Предмет коллоидной химии
Наука о поверхностных явлениях и дисперсных системах называется коллоидной химией.
К поверхностным явлениям относятся процессы, происходящие на поверхности раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряженных фаз. Каждое тело ограничено поверхностью, поэтому объектами коллоидной химии могут быть тела любого размера. Однако поверхностные явления проявляются сильнее всего в телах с высокоразвитой поверхностью, которая придает им новые важные свойства.
Дисперсные системы, рассматриваемые в коллоидной химии, состоят как минимум из двух фаз. Одна из них является сплошной и называется дисперсионной средой. Другая фаза раздроблена и распределена в первой, ее называют дисперсной фазой[1].
Классификация дисперсных систем
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсной фазы и дисперсионной среды. Три агрегатных состояния (твердое, жидкое и газообразное) позволяют выделить девять типов дисперсных систем (табл. 1.1). Для краткости их условно обозначают дробью, числитель которой указывает на агрегатное состояние дисперсной фазы, а знаменатель – дисперсионной среды. Например, дробью Т/Ж обозначают системы с твердой дисперсной фазой и жидкой дисперсионной средой (твердое в жидкости). Одно из девяти сочетаний Г/Г в обычных условиях не может образовать коллоидной системы, так как газы при любых соотношениях дают истинные растворы. Однако и газы могут проявлять некоторые свойства коллоидных систем благодаря непрерывным флуктуациям плотности и концентрации, вызывающим неоднородности в системе.
Из представленной классификации видно, что все дисперсные системы по кинетическим свойствам дисперсной фазы можно разделить на два класса: свободнодисперсные системы, в которых дисперсная фаза подвижна, и связнодисперсныесистемы – системы с твердой дисперсионной средой, в которой частицы дисперсной фазы не могут свободно передвигаться. К свободнодисперсным системам относятся золи, к связнодисперсным – гели.
Дисперсные системы классифицируют по дисперсности. Для свободнодисперсных и связнодисперсных систем классификации по дисперсности имеют существенные различия.
Таблица 1.1
Классификация дисперсных систем по агрегатному состоянию фаз
| Условное обозначение системы | Название системы и примеры |
| Т/Т | Твердые гетерогенные системы: минералы, сплавы, бетон, композиционные материалы |
| Ж/Т | Капиллярные системы: жидкость в пористых телах, адсорбенты в растворах, почвы, грунты |
| Г/Т | Пористые тела: адсорбенты и катализаторы в газах |
| Т/Ж | Суспензии и золи: промышленные суспензии, пульпы, взвеси, пасты, илы |
| Ж/Ж | Эмульсии: природная нефть, кремы, молоко |
| Г/Ж | Газовые эмульсии и пены: флотационные, противопожарные, мыльные пены |
| Т/Г | Аэрозоли (пыли, дымы), порошки |
| Ж/Г | Аэрозоли, туманы, в том числе промышленные, облака |
| Г/Г | Коллоидные системы отсутствуют |
Свободнодисперсные системы подразделяются на ультрамикрогетерогенные, размер частиц которых лежит в пределахот 10–7 до 10–5 см (от 1 до 100 нм), микрогетерогенные с размером частиц от 10–5 до 10–3 см (от 0,1 до 10 мкм) и грубодисперсные с частицами, размер которых превышает 10‑3 см.
Ультрамикрогетерогенные системы часто называют истинно коллоидными или просто коллоидными, так как раньше только такие системы считались объектом коллоидной химии. Сейчас термин «коллоидный» стал применяться в широком смысле, равноценном термину «гетерогенно-дисперсный», а за ультрамикрогетерогенными системами осталось название «золи».
Связнодисперсные системы, точнее, пористые тела, классифицируют на микропористые – с размерами пор до 2 нм, переходно-пористые – от 2 до 200 нм и макропористые – выше 200 нм. Системы Т/Т часто удобнее подразделять по дисперсности так же, как и свободнодисперсные системы.
По термодинамической устойчивости дисперсные системы классифицируют на лиофильные (термодинамически устойчивые) и лиофобные (термодинамически неустойчивые) [2].
Методы получения дисперсных систем
Лиофобные дисперсные системы (термодинамически неравновесные) могут быть получены двумя путями: конденсацией молекул и дроблением более крупных частиц до нужной степени дисперсности.
Конденсационный путь образования дисперсных систем связан с выделением новой фазы из гомогенной системы, находящейся в метастабильном состоянии, например, кристаллизация из пересыщенного раствора, конденсация пересыщенного пара и т. п. Этот процесс протекает в том случае, если химический потенциал вещества в новой (стабильной) фазе меньше, чем в старой ( 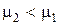 ). Однако этот выгодный в конечном счете процесс проходит через стадию, требующую затраты энергии, – стадию образования зародышей новой фазы. Условия для возникновения зародышей новой фазы возникают в метастабильной системе в местах, где образуется местное пересыщение – флуктуации плотности (концентрации) достаточной величины. Радиус равновесного зародыша новой фазы связан со степенью пересыщения известной зависимостью (для жидкой капельки, образующейся в пересыщенном паре):
). Однако этот выгодный в конечном счете процесс проходит через стадию, требующую затраты энергии, – стадию образования зародышей новой фазы. Условия для возникновения зародышей новой фазы возникают в метастабильной системе в местах, где образуется местное пересыщение – флуктуации плотности (концентрации) достаточной величины. Радиус равновесного зародыша новой фазы связан со степенью пересыщения известной зависимостью (для жидкой капельки, образующейся в пересыщенном паре):
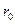 = = 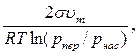 | (1.1) |
где s и 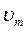 – поверхностное натяжение и молярный объем жидкой капельки; p
– поверхностное натяжение и молярный объем жидкой капельки; p 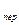 и p
и p 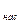 – упругости пересыщенного и насыщенного пара соответственно.
– упругости пересыщенного и насыщенного пара соответственно.
Из уравнения видно, что для образования зародышей новой фазы необходимо пересыщение p 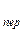 /p
/p 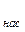 >1. Чем больше степень пересыщения, тем меньше равновесный размер зародышей, тем легче он образуется.
>1. Чем больше степень пересыщения, тем меньше равновесный размер зародышей, тем легче он образуется.
Размеры образующихся частиц зависят от условий проведения процесса конденсации, в принципе – от соотношения между скоростями одновременно идущих процессов: образование зародышей и роста их. Для получения мелких частиц (т. е. частиц дисперсной фазы в будущей дисперсной системе) необходимо значительное преобладание скорости первого процесса над скоростью второго. Практически такие условия создаются либо в весьмав разбавленных растворах реагирующих веществ, либо, наоборот, в достаточно концентрированных растворах, когда образуется сразу много зародышей в процессе кристаллизации, не успевших вырасти до больших размеров. В первом случае образуется золь (коллоидная система), во втором получается мелкокристаллический осадок, который можно в определенных условиях перевести в коллоидный раствор.
Химическая конденсация
Если при химической реакции образуется труднорастворимое соединение, то оно при определенных условиях может быть получено в виде коллоидного раствора. Для этого нужно, во-первых, вести реакцию, разбавленную в растворе, чтобы скорость роста кристаллических частиц была невелика, тогда частицы получаются мелкие (10–7¼10–9 м) и системе будет обеспечена седиментационная устойчивость; во-вторых, одно из реагирующих веществ взять в избытке, чтобы на поверхности кристалла мог образоваться двойной электрический слой – основной фактор агрегативной устойчивости [2].
Физическая конденсация
В основе способа лежит конденсация молекул одного вещества – будущей дисперсной фазы, в другом веществе – будущей дисперсионной среды. Практически это может быть осуществлено различными путями, например, пропусканием одного вещества в другое.
Одним из примеров физической конденсации является метод замены растворителя: раствор какого-либо вещества постепенно, при перемешивании, прибавляют к жидкости, в которой это вещество нерастворимо. При этом происходит конденсация молекул и образование коллоидных частиц.
Таким способом можно получить гидрозоли серы, фосфора, канифоли, антрацена и других веществ, вливая их спиртовые растворы в воду. Строение двойного электрического слоя в этих системах недостаточно известно [2].
Дробление
Механическое дробление осуществляется в различного рода мельницах (для получения коллоидной дисперсности применяют дисперсные мельницы), с помощью ультразвука, в вольтовой дуге (для получения золей металлов) и т. д.
Дробление частиц малых размеров требует большой затраты работы, так как поверхность раздела между фазами в таких системах должна быть очень велика. Образующиеся при дроблении частицы имеют тенденцию самопроизвольного слипания (коагуляции), поэтому дробление следует производить в дисперсной среде в присутствии стабилизаторов – ионов или поверхностно-активных веществ.
Дробление в присутствии поверхностно-активного вещества (ПАВ) требует меньшие затраты работы. Эффект значительного понижения сопротивляемости твердых тел разрушения в результате адсорбции ПАВ был обнаружен Ребиндером П.А. и получил название адсорбционного понижения прочности [2].
