Работа №10. Изучение скорости разложения пероксида водорода газоволюметрическим методом
Пероксид водорода в водных растворах самопроизвольно медленно разлагается по уравнению
Н2О2 → Н2О + 0.5О2
Скорость реакции значительно увеличивается при повышении температуры или в присутствии катализаторов: ионов Fe2+, Fe3+, Сr2О72-, CrO42-, WO42-, МоО42-, смесей: CuSO4+МoО42-, CuSO4+NiSO4 и многих других. За ходом процесса удобно наблюдать по изменению объема выделившегося кислорода при постоянных температуре и давлении через различные промежутки времени от начала реакции.

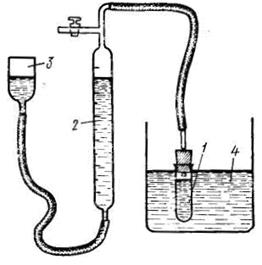 Последовательность выполнения работы. В настроенный на заданную преподавателем температуру термостат 4 поместить колбу вместимостью 200-300 мл, содержащую 50 мл раствора катализатора. Одновременно термостатировать реакционный сосуд 1 (рис. 1). Спустя 15-20 мин в колбу с раствором катализатора влить определенное количество пероксида водорода (~0.7 мл), отметив этот момент как время начала реакции. Смесь тщательно размешать и поместить реакционный сосуд, заполнив его так, чтобы высота воздушного пространства между уровнем жидкости и пробкой не превышала 2 см. Сосуд с реакционной смесью поместить в термостат 4 и соединить с измерительной системой, состоящей из уравнительного сосуда 3 и бюретки 2, заполненных подкрашенной водой. Кран 5 в течение 1-2 мин держать открытым (связанным с атмосферой) для вытеснения воздуха выделяющимся кислородом из реакционного сосуда, затем выставить положение жидкости в бюретке на ноль и закрыть его, соединив таким образом реакционный сосуд с газовой бюреткой. После этого через 1 минуту произвести первое измерение и записать уровень жидкости по бюретке и время. Каждое следующее измерение сопровождается такой же записью, причем уровни жидкости в бюретке и уравнительном сосуде непрерывно поддерживаются одинаковыми. Измерения необходимо проводить через 1 минуту до тех пор, пока выделяется больше, чем 1 мл газа, затем увеличивать промежутки времени до 2, 3 и 5 минут. После того как реакция практически прекратится, реакционный сосуд поместить в кипящую водяную баню и выдержать в ней до полного разложения пероксида водорода (около 15-20 минут). При кипячении на водяной бане уравнительный сосуд должен находиться в наиболее низком положении. Затем реакционный сосуд снова поместить в термостат на 15-20 мин и измерить уровень жидкости в бюретке. Результаты записать в таблицу по образцу:
Последовательность выполнения работы. В настроенный на заданную преподавателем температуру термостат 4 поместить колбу вместимостью 200-300 мл, содержащую 50 мл раствора катализатора. Одновременно термостатировать реакционный сосуд 1 (рис. 1). Спустя 15-20 мин в колбу с раствором катализатора влить определенное количество пероксида водорода (~0.7 мл), отметив этот момент как время начала реакции. Смесь тщательно размешать и поместить реакционный сосуд, заполнив его так, чтобы высота воздушного пространства между уровнем жидкости и пробкой не превышала 2 см. Сосуд с реакционной смесью поместить в термостат 4 и соединить с измерительной системой, состоящей из уравнительного сосуда 3 и бюретки 2, заполненных подкрашенной водой. Кран 5 в течение 1-2 мин держать открытым (связанным с атмосферой) для вытеснения воздуха выделяющимся кислородом из реакционного сосуда, затем выставить положение жидкости в бюретке на ноль и закрыть его, соединив таким образом реакционный сосуд с газовой бюреткой. После этого через 1 минуту произвести первое измерение и записать уровень жидкости по бюретке и время. Каждое следующее измерение сопровождается такой же записью, причем уровни жидкости в бюретке и уравнительном сосуде непрерывно поддерживаются одинаковыми. Измерения необходимо проводить через 1 минуту до тех пор, пока выделяется больше, чем 1 мл газа, затем увеличивать промежутки времени до 2, 3 и 5 минут. После того как реакция практически прекратится, реакционный сосуд поместить в кипящую водяную баню и выдержать в ней до полного разложения пероксида водорода (около 15-20 минут). При кипячении на водяной бане уравнительный сосуд должен находиться в наиболее низком положении. Затем реакционный сосуд снова поместить в термостат на 15-20 мин и измерить уровень жидкости в бюретке. Результаты записать в таблицу по образцу:
Температура опыта, оС………; катализатор………; количество пероксида водорода………
| № | Время измер. по часам | Время от начала реакции | Уровень жидкости в бюретке | Объём выделив-шегося газа, см3 | Скор-ть реакции | 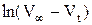 | 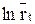 | k | kср |
| . . |
По полученным экспериментальным данным:
1) Построить кинетическую кривую – график зависимости разности объемов кислорода от времени 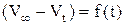 (на оси абсцисс откладывать время в минутах). По этому графику найти скорости реакции в различные моменты времени, как тангенсы угла наклона касательных к кинетической кривой;
(на оси абсцисс откладывать время в минутах). По этому графику найти скорости реакции в различные моменты времени, как тангенсы угла наклона касательных к кинетической кривой;
2) Дифференциальным методом Вант-Гоффа определить порядок реакции. Для этого построить зависимость логарифма скорости реакции, через различные промежутки времени от логарифма разности объемов выделенного кислорода 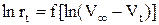 и найти порядок реакции, как тангенс угла наклона полученной прямой;
и найти порядок реакции, как тангенс угла наклона полученной прямой;
3) Подтвердить порядок реакции графическим вариантом метода подбора, построив график зависимости логарифма разности объемов кислорода от времени 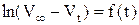 .
.
При помощи графика 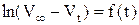 определить константу скорости реакции. Рассчитать также константу скорости реакции по времени полупревращения и используя кинетическое уравнение реакции первого порядка в интегральной форме, в котором концентрации Н2О2 в начальный момент и в момент измерения t заменить разностями объемов кислорода:
определить константу скорости реакции. Рассчитать также константу скорости реакции по времени полупревращения и используя кинетическое уравнение реакции первого порядка в интегральной форме, в котором концентрации Н2О2 в начальный момент и в момент измерения t заменить разностями объемов кислорода:
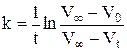 (1)
(1)
где V∞ - объем кислорода, выделившийся после разложения всего пероксида водорода (определяется как разность уровней в бюретке в момент, принятый за начало реакции, и после кипячения Н2О2 до полного разложения); V0 – уровень жидкости в начальный момент; определяется экстраполяцией прямой в координатах 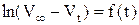 до t=0.
до t=0.
Сравнить полученные значения констант скорости реакции.
