Диссоциация кислот, оснований и солей
Представления о кислотах и основаниях существовали задолго до появ-
ления теории электролитической диссоциации.
Так, кислотами считали вещества, обладающие определенными свойст-
вами: кислый вкус (именно за это свойство эти вещества получили название ки-
слот), способность взаимодействовать с некоторыми металлами с выделением
водорода, изменять окраску многих индикаторов, реагировать с основаниями с
образованием солей.
Щелочами же было принято считать вещества, которые способны раство-
рять серу, масла, быть мыльными на ощупь и главное – нейтрализовать дейст-
вие кислот. Их первоначально получали из золы различных растений. Затем
представления о щелочах было расширено до понятия основания, в которое
включили и щелочи, и щелочные земли, и щелочные металлы и ряд других ве-
ществ. А основным свойством всех этих веществ стала их способность образо-
вывать с кислотами соли.
Новые представления о растворах, связанные с электролитической диссо-
циацией, позволили С. Аррениусу объяснить природу кислот и оснований в
водных растворах.
Согласно представлениям С. Аррениуса кислота есть всякое водородосо-
держащее соединение, которое в водном растворе при диссоциации образует
ион водорода Н+, как, например:
HCl → H+ + Cl- ,
HNO3 → H+ + NO3-,
H2SO4 → 2H+ + SO42-.
А основание – всякое гидроксилсодержащее соединение, которое в вод-
ном растворе при диссоциации дает ион гидроксила ОН-, например:
NaOH → OH- + Na+ ,
Ba(OH)2 → 2OH- + Ba2+.
Процесс нейтрализации кислоты основанием заключается во взаимодей-
ствии ионов водорода Н+ и гидроксила ОН- с образованием воды:
Н+ + ОН- → Н2О.
Кислые растворы обязаны своим вкусом присутствию ионов водорода Н+
(а точнее [Н3О]+), а основания имеют характерный мыльный вкус благодаря
ионам гидроксила ОН-.
Заметим, что данные модельные представления С. Аррениуса о кислотах
и основаниях не являются универсальными. Они применимы лишь к водным
растворам, так как хорошо объясняют их электропроводность, каталитические
свойства кислот (вследствие большой подвижности ионов водорода). А также
факт примерно одного и того же значения теплового эффекта реакции нейтра-
лизации различных кислот основаниями, равным ∆Н = -58 кДж/моль, так как в
основе лежит одна и та же реакция ─ соединение иона водорода с ионом гидро-
ксила, и становятся понятными многие другие стороны поведения кислот, оснований.
Кислотно-основные свойства химических соединений
Любое вещество в определенных условиях может проявлять свойства кислоты и основания по отношению к какому-либо другому веществу, включая и растворитель.
Со времен Аррениуса, по определению которого кислоты в водных растворах диссоциируют на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятой считается протонная теория Бренстеда–Лоури. Протонная теория Бренстеда–Лоури применима лишь к протон-содержащим или протон- присоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:
HAn ↔ An– + Н+
По определению, HAn – кислота, An– – основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание. В определенных условиях многие вещества могут вести себя как кислота или как основание в зависимости от того, с каким другим веществом оно вступает в реакцию. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
Пример 1:
1) Н2СО3 ↔ Н+ + НСО3–, 2) НСО3–↔ Н+ + СО32–
к о к о
В первом случае гидрокарбонат-анион НСО3– является основанием, сопряженным угольной кислоте Н2СО3, во втором – кислотой, сопряженной карбонат-аниону СО32–.
Пример 2:
1) NH3 + H2O ↔ NH4+ + OH–, 2) HF + H2O ↔ H3O+ + F–
о к к о к о к о
В первом уравнении вода является кислотой, сопряженной гидроксил-аниону ОН-, во втором – основанием, сопряженному гидроксоний-катиону H3O+
В дальнейшем появилось много других экспериментальных данных, свя-
занных в основном с неводными растворителями, и соответственно новых кон-
цепций понимания кислот и оснований. Так, например, растворенная соляная
кислота НСl в бензоле реагирует с аммиаком в качестве кислоты (отдает протон
Н+). Аммиак ведет себя в этой реакции как основание, так как образует вместе с
кислотой соль NH4Cl. И вода в этой реакции не образуется, и нет ионов гидро-
ксилов – символа основания. Символически эту реакцию можно представить
следующей схемой:
NH3 + HCl → NH3 + H+ + Cl- → NH4+ + Cl- .
Классифицировать подобные взаимодействия позволила электронная теория кислот и оснований Льюиса.
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару. Основанием Льюиса могут быть анионы (Cl-, OH-) или нейтральные молекулы (H2O, NH3).
Кислотами Льюиса могут быть катионы (H+, Fe2+) или нейтральные молекулы, имеющие свободные валентные орбитали (BF3, AlCl3, ZnCl2)
При взаимодействии донора электронной пары :NН3 (основание) и акцептора электронной пары НCl (кислота) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи.
Аналогично при взаимодействии донора электронной пары :NН3 (основание) и акцептора электронной пары BF3 (кислота) образуется устойчивое соединение за счет донорно-акцепторной (двухэлектронной двухцентровой) связи.
Н3N: + ⇔BF3 → Н3N― BF3
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато.
Так, например, молекулы угольной кислоты Н2СO3 вначале диссоциируют с отще-
плением одного иона водорода по уравнению
1) H2СO3↔ H+раствор + [HСO3]-раствор.
Степень диссоциации этого процесса α1. Затем образовавшиеся кислые анионы угольной кислоты [HСO3]- в свою очередь распадаются под действием молекул воды на более простые ионы:
2) [HСO3]- ↔ H+раствор + [СO3]2-раствор
с отщеплением второго иона водорода. Но этот процесс идет уже много труд-
нее, так как иону водорода Н+ приходится отрываться уже от заряженной отри-
цательно частицы, а не от нейтральной молекулы, как в первом случае. Поэто-
му степень диссоциации второй ступени α2 характеризуется меньшим значени-
ем, т.е. α1>α2. Вследствие этого в растворе содержится лишь небольшое число
ионов [СO3]2-.
Фосфорная кислота диссоциирует в три ступени:
1) Н3РО4 ↔ Н+ + [Н2РО4]-,
2) [H2PO4]- ↔ H+ + [HPO4]2-,
3) [HPO4]2- ↔H+ + [PO4]3-,
каждая из них так же характеризуется соответствующей степенью диссоциа-
ции: α1, α2 и α3, которые тоже находятся в следующем соотношении:
α 1> α 2 > α 3.
А это означает, что ионов [PO4] 3- в растворе почти нет.
Основания, содержащие более одной гидроксильной группы в молекуле,
также диссоциируют ступенчато. Например, гидроксид кальция Са(ОН)2 диссо-
циирует в две стадии:
1) Са(ОН)2 → [CaOH]+ + OH- (α1)
2) [CaOH] + → Ca 2++ OH - (α2).
Гидроксиды многих металлов (Zn(OH)2, Al(OH)3, Be(OH)2, Cr(OH)3, Pb(OH)2 и
других) могут диссоциировать и по кислотному, и по основному механизму.
Например, диссоциацию гидроксида цинка Zn(OH)2 можно выразить уравне-
ниями:
1) Zn(OH)2 ↔ [Zn(OH)]+ + OH-,
2) H2ZnO2 ↔ [HZnO2]+ + H+
или
[Zn(OH)]+ + OH- ↔ Zn(OH)2 ↔ H2ZnO2 ↔ [HZnO2]- + H+.
Диссоциация по тому или иному пути определяется в зависимости от среды: в
кислой среде, где концентрация ионов водорода Н+ велика, ионы гидроксила
связываются с ионами водорода, смещая равновесие в сторону образования ио-
нов [Zn(OH)]+, а в щелочной (концентрация ОН- значительна) ионы ОН-, взаимо-
действуя с ионами водорода, смещают равновесие в сторону образования ионов
[HZnO2]-. Так или иначе оба процесса приводят к образованию слабого электро-
лита – воды:
Н+ + ОН- = Н2О.
Соединения, которые в зависимости от условий диссоциируют как по ки-
слотному, так и по основному механизму, называют амфотерными электроли-
тами, или амфолитами (от греческого “amphoteros” – обоюдный, в смысле
двусторонний).
Соли, как известно, являются продуктом реакции нейтрализации. В зави-
симости от полноты нейтрализации соли могут быть: средние, или нейтральные
(например, К3РО4, Са(NO3)2, NaCl); кислые, если не все водородные ионы в моле-
куле кислоты замещены на металл (например, КН2РО4, NaHSO4, СsHCO3), и ос-
новные, если в составе молекулы соли имеется гидроксильная группа ОН- (на-
пример, ZnOHCl, Fe(OH)2Cl, AlOHSO4). В водных растворах они диссоциируют на
катионы металлов (или комплексные катионы) и анионы (одноатомные или
многоатомные).
Средние соли называют используя название кислотного остатка в именительном падеже и катиона металла в родительном. Например, соли К3РО4, Са(NO3)2, NaCl называют фосфат калия, нитрат кальция, хлорид натрия соответственно.
Кислые соли называют аналогичным образом, добавляя к названию кислотного остатка приставку гидро, дигидро, тригидро, и.т.д. Например, соли КН2РО4, NaHSO4, СsHCO3 называют дигидрофосфат калия, гидросульфат натрия, гидрокарбонат цезия соответственно.
Основные соли называют аналогично средним, добавляя к названию катиона приставку гидроксо, дигидроксо и. т.д. Например, соли ZnOHCl, Fe(OH)2Cl, AlOHSO4 называют хлорид гидроксоцинка, хлорид дигидроксожелеза, сульфат гидроксоалюминия соответственно.
Средние соли диссоциируют практически полностью. Например, в вод-
ном растворе сульфата натрия Na2SO4 практически нет молекул Na2SO4, а имеют-
ся только ионы Na+ и SO42-, что выражается уравнением
Na2SO4 → 2 Na+ + SO42-.
Кислые соли диссоциируют ступенчато, отщепляя вначале ионы метал-
лов, а затем ионы водорода, например:
1) KН2РО4 → К+ + [Н2 РО4]-,
2) [H2PO4]- ↔ H+ + [HPO4]2-,
3) [HPO4]2- ↔ H+ + [PO4]3-.
Ступенчато диссоциируют также и основные соли. Например, дигидрок-
сохлорид железа Fe(OH)2Cl диссоциирует в три стадии, которые можно предста-
вить следующими уравнениями:
1) Fe(OH)2Cl → [Fe(OH)2]+ + Cl-,
2) [Fe(OH)2]+ ↔ [Fe(OH)]2+ + OH-,
3) [Fe(OH)]2+ ↔ Fe3+ + OH-.
Диссоциация кислых и основных солей протекает практически полно-
стью по первой ступени. На тех стадиях, когда происходит распад сложных
анионов кислых солей или катионов основной соли (появляются ионы водорода
или гидроксила) степень диссоциации очень незначительна. А это значит, что в
растворе практически отсутствуют ионы РО43- и Fe3+ при ступенчатой диссоциа-
ции дигидрофосфата калия и дигидроксохлорида железа соответственно в при-
веденных примерах.
Константа диссоциации
Процесс диссоциации является обратимым. Наряду с распадом нейтраль-
ных молекул на ионы протекает и обратный процесс ассоциации, взаимодейст-
вия ионов между собой с образованием исходных, нейтральных молекул. При
постоянстве внешних условий (температуры, концентрации, давления) в рас-
творе рано или поздно устанавливается равенство скоростей процессов диссо-
циации и ассоциации. Наступает равновесие.
Рассмотрим наиболее простой случай диссоциации молекул растворенно-
го вещества на два иона (говорят: бинарный электролит). В качестве примера
возьмем раствор уксусной кислоты СН3СООН, диссоциирующий по уравнению
СН3СООН ↔ CH3COO- + H+.
Константа равновесия этого процесса Кр согласно закону действующих масс за-
пишется в виде выражения:
[CH3COO−] · [ H+] CМ (CH 3COO−) · CМ (H+)
Кр = ―—————— или Кр = ————————————
[CH3COOH ] CМ CH3COOH
где [CH3COO-] = CМ (CHзСОО-), [H+] = CМ(H+)и [CH3COOH] = CМ (CHзCOOH) ─ молярные концентрации соответственно ацетат-иона, иона водорода и нераспавшихся молекул уксусной кислоты.
Поскольку константа равновесия относится к процессу диссоциации, то
ее можно назвать константой диссоциации Кд. Она показывает, что в состоянии
равновесия концентрации образовавшихся ионов и нераспавшихся молекул на-
ходятся во взаимосвязи. Изменение концентрации любого из компонентов в
растворе, автоматически приведет к изменению концентрации других, но так,
чтобы их соотношение оставалось тем же самым – равным константе диссоциа-
ции Кд = Кр.
Если константа диссоциации больше единицы (числитель выражения
больше знаменателя), то в растворе очень мало нераспавшихся молекул и много
ионов. Следовательно, чем меньше константа диссоциации, тем слабее диссо-
циирует растворенное вещество, тем прочнее его молекулы в данном раствори-
теле. Зная величины констант диссоциации различных веществ в данном рас-
творителе, можно судить и об их степени диссоциации в растворе. А какова ана-
литическая связь константы равновесия со степенью диссоциации, ведь по-
следняя зависит от концентрации?
Предположим, что исходная концентрация растворяемой уксусной ки-
слоты С моль/л (молярная). Растворившись в воде, молекулы уксусной кислоты частично будут распадаться на ионы. Если степень диссоциации α, то равновесная концентрация распавшихся молекул на ионы будет αСМ , а равновесная концентра-
ция оставшихся (нераспавшихся) молекул уксусной кислоты будет составлять
разницу между исходной концентрацией растворенных молекул С и концентра-
цией распавшихся αС:
СМ – αСМ = [CH3COOH].
При распаде одной молекулы СН3СООН на ионы образуется соответственно
один ион водорода Н+ и один ацетат–ион СН3СОО- (см. уравнение диссоциации
уксусной кислоты). Если же распадается на ионы αС молей СН3СООН, то соот-
ветственно и концентрация образовавшихся молей ионов водорода будет αС и
ацетат─ ионов тоже αС, то есть равновесные концентрации ионов равны между
собой и составляют величину: αС = [H+] = [CH3COO-].
Подставим значения равновесных концентраций частиц в выражение
константы диссоциации:
[H+] · [CH3COO− ] αC · αC
Кд = ———————— = —————— .
[CH3COOH ] C − αC
После упрощения (сократив числитель и знаменатель на С) получим:
α2C
Кд = —— .
1 - а
Полученное выражение носит название закона разбавления В. Оствальда.
Оно связывает степень диссоциации с концентрацией растворенного вещества.
Для слабых электролитов, у которых степень диссоциации меньше 0,03
(α < 0,03), величиной α в знаменателе этого выражения можно пренебречь, так
как 0,03 много меньше единицы (0,03 << 1). Тогда уравнение В. Оствальда
можно упростить: ([H+] << С)
Кд ≈ α 2С или α= 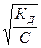 .
.
Теперь явно видно, что степень диссоциации обратно пропорциональна кон-
центрации растворенного вещества: чем выше концентрация, тем меньше сте-
пень диссоциации.
Слабые многоосновные кислоты, а также двух- и более кислотные осно-
вания характеризуются несколькими константами диссоциации, соответствую-
щими каждой ступени диссоциации. Например, угольная кислота Н2СО3 имеет
две константы диссоциации: Кд 1 = 4,45 · 10-7 и Кд 2 = 4,69 · 10-11, которые соответству-
ют двум ступеням диссоциации:
1) Н2СО3 = Н+ + НСО3- (Кд1= 4,45 · 10-7),
2) НСО3- = Н+ + СО32- (Кд2= 4,69 · 10-11).
Константа диссоциации каждой последующей ступени на несколько по-
рядков (как правило, на 10-5) ниже предыдущей (см. таблицу 2.8).
Таблица 2.8
