ЗАДАНИЕ №3 по теме «ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ»
Примеры решения задач
1.1. Вычисление скорости химических реакций
Пример 1. Как запишется закон действия масс для реакции горения угля
С + O2 → СО?
Решение: В случае гетерогенных реакций в уравнения закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация вещества, находящегося в твердой фазе, обычно представляет собою постоянную величину и поэтому входит в константу скорости.
W = k'· const · [O2] = k · [O2] , где k = k' ·const.
Пример 2. Написать выражение закона действия масс для реакций
а) 2NO (г.) + Cl2 (г.) → 2NOCl (г.);
б) CaCO3 (к.) → СaO (к.) + CO2 (г.).
Решение: а) v = k[NO]2[Cl2] ;
б) Поскольку карбонат кальция – твердое вещество, концентрация которого не изменяется в ходе реакции, искомое выражение будет иметь вид v = k, т.е. в данном случае скорость реакции при определенной температуре постоянна.
Пример 3.Предскажите, как изменится скорость газовой реакции
A + 2B + 3D → F при повышении общего давления в 3 раза.
Решение: Пусть W1–скорость при некотором первоначальном давлении рA, рB, рD: W1 = k рA рB2рD3.
Пусть W2 – скорость при концентрациях 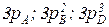 . Тогда скорость возрастет:
. Тогда скорость возрастет:
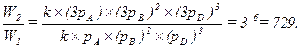
Таким образом, увеличение общего давления в 3 раза приводит к увеличению парциальных давлений компонентов в то же число раз, что скажется в 729-кратном увеличении скорости.
Пример 4. Как изменится скорость реакции
2NO (г.) + O2 (г.) = 2NO2 (г.),
если уменьшить объем реакционного сосуда в 3 раза?
Решение: До изменения объема скорость реакции выражалась уравнением
v = k[NO]2[O2].
Вследствие уменьшения объема концентрация каждого из реагирующих веществ возрастет в 3 раза. Следовательно,
v' = k(3[NO])2(3[O2]) = 27k[NO]2[O2].
Сравнивая выражения для v и v', находим, что скорость реакции возрастет в 27 раз.
1.2. Влияние температуры и природы веществ на скорость реакции
Пример 1. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 750С?
Решение: Поскольку Δt = 550С, то обозначив скорость реакции при 20 и 750С соответственно через v и v', можем записать:
v'/v = 2,855/10 =2,85,5; lg(v'/v) = 5,5lg2,8 = 5,5.0,447 = 2,458.
Отсюда v'/v = 287. Скорость реакции увеличится в 287 раз.
Пример 2. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, а с катализатором – 50,14 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 250С?
Решение: Обозначим энергию активации реакции без катализатора через Еа, а с катализатором – через Е′а; соответствующие константы скорости реакции обозначим через k и k'. Используя уравнение Аррениуса, находим:
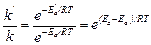
Отсюда:
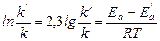 ;
; 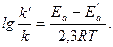
Подставляя в последнее уравнение данные задачи, выражая энергию активации в джоулях и учитывая, что Т = 298 К, получим
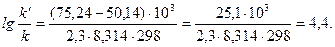
Окончательно находим: k'/k = 2,5.104.
1.3. Вычисление константы химического равновесия
Пример. При некоторой температуре константа диссоциации йодоводорода на простые вещества равна 6,25.10-2. Какой процент HI диссоциирует при этой температуре?
Решение: Уравнение реакции диссоциации HI:
2 HI ↔ H2 + I2
Обозначим начальную концентрацию HI через С моль/л. Если к моменту наступления равновесия из каждых С молей йодоводорода диссоциировано х молей, то при этом, согласно уравнению реакции, образовалось 0,5х моль H2 и 0,5х моль I2. Таким образом, равновесные концентрации составляют
[HI] = (С – х) моль/л; [H2] = [I2] = 0,5х моль/л.
Подставим эти значения в выражение константы равновесия реакции:
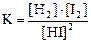 ;
; 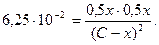
Извлекая из обеих частей уравнения квадратный корень, получим 0,25 = 0,5х/(С – х), откуда х = 0,333 С.
Таким образом, к моменту наступления равновесия диссоциировало 33,3% исходного количества йодоводорода.
1.4. Вычисление равновесных концентраций
Пример. В системе А (г.) + 2В (г.) = С (г.) равновесные концентрации равны: [A] = 0,06 моль/л; [B] = 0,12 моль/л; [C] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение: Константа равновесия данной реакции выражается уравнением
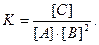
Подставляя в него данные задачи, получаем
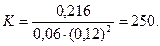
Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции, из 1 моль А и 2 моль В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моль вещества С, то при этом было израсходовано 0,216 моль А и 0,216·2 = 0,432 моль В.
| Исходные вещества | А | В | С |
| Равновесные концентрации | [A]p = 0,06 моль/л | [B]р = 0,12 моль/л | [C]р = 0,216 моль/л |
| Соотношение реагирующих веществ | |||
| Количество израсходованного/обра- Зовавшегося вещества в 1 л | 0,216 | 0,216 ∙ 2 = 0,432 | 0,216 |
| Исходные концентрации | [A]0 = 0,06 + 0,216 = 0,276 моль/л | [B]0 = 0,12 + 0,432 = 0,552 моль/л |
Таким образом, исходные концентрации равны: [A]0 = 0,276 моль/л;
[B]0 = 0,552 моль/л.
1.5. Направление смещения равновесия
Пример. В каком направлении сместится равновесие в системах
а) СО (г.) + Cl2 (г.) ↔ СОСl2 (г.),
б) Н2 (г.) + I2 (г.) ↔ 2 HI (г.),
если при неизменной температуре увеличить давление путем уменьшения объема газовой смеси?
Решение: а) протекание реакции в прямом направлении приводит к уменьшению общего числа молей газов, т.е. к уменьшению давления в системе. Поэтому, согласно принципу Ле-Шателье, повышение давления вызывает смещение равновесия в сторону прямой реакции;
б) протекание реакции не сопровождается изменением числа молей газов и не приводит, следовательно, к изменению давления. В этом случае изменение давления не вызывает смещения равновесия.
