Лабораторная работа № 6. Свойства элементов VI А группы
Цель работы: изучение химических свойств элементов VI А .группы.
Кислород
Общие сведения
В главную подгруппу VI группы периодической системы входят кислород, сера, селен, теллур, полоний. Все элементы VI А группы могут давать соединения с водородом с общей формулой H2Х. Водородные соединения летучи, будучи растворены в воде диссоциируют как слабая кислота. В бинарных соединениях с менее электроотрицательными элементами проявляют степень окисления −2. Валентные возможности для всех элементов – от II до VI, кроме кислорода, у которого единственное значение валентности, равное двум.
Сильнее всего неметаллический характер выражен у кислорода и серы. Селен и теллур занимают промежуточное положение между металлами и неметаллами. В элементарном состоянии селен может существовать как в неметаллической, так и в металлической модификациях. Для теллура металлическая модификация является даже наиболее обычной.
Наиболее характерной особенностью кислорода является его способность соединяться с большинством элементов, выступая при этом в качестве окислителя.
К соединениям кислорода принято относить оксиды, гидроксиды, пероксиды. Перекисные соединения формально являются производными перекиси водорода. Отличительной особенностью перекисей является наличие кислородного мостика −О−О−, наличие которого обеспечивает высокую реакционную способность перекисных соединений. Степень окисления кислорода в перекисях равна −1. следовательно, перекиси могут быть как окислителями, так и восстановителями.
Выполнение работы
Опыт 1. Окислительные свойства перекиси водорода. К раствору соли хрома (III) прибавить по каплям концентрированный раствор щелочи до растворения образующегося осадка гидроксида хрома. К полученному раствору комплексной соли хрома (III) прибавить концентрированный раствор перекиси водорода и нагреть. Цвет раствора изменится с зеленого на желтый из-за образования хромата: 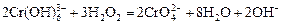 .
.
Вследствие того, что соли тяжелых металлов каталитически ускоряют реакцию диспропорционирования пероксида водорода, происходит также частичное разложение Н2О2 с выделением кислорода (написать уравнение реакции).
Опыт 2. Восстановительные свойства перекиси водорода. К нескольким каплям концентрированной перекиси водорода прибавить 2–4 капли 2,5 М серной кислоты и 1–2 капли раствора перманганата калия. Наблюдать обесцвечивание раствора, сопровождающееся выделением газа (кислород):
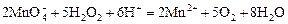 .
.
Опыт 3. Диспропорционирование перекиси водорода. К нескольким каплям концентрированной перекиси водорода прибавить 2–4 капли 2 н. серной кислоты и 2–3 капли сульфата марганца (II). Выделяющийся газ идентифицировать с помощью тлеющей лучинки.
Опыт 4. Обнаружение перекиси водорода. К нескольким каплям подкисленной серной кислотой (2 н.) перекиси водорода прибавить 0,1 М раствор сульфата титанила TiOSO4. Наблюдается желтое окрашивание.
Сера
Общие сведения
Чистая сера представляет собой желтое кристаллическое вещество. При обычных условиях сера сравнительно инертна. При нагревании реагирует с хлором, бромом, кислородом, водородом, металлами.
Соединение серы и водорода – сероводород – бесцветный ядовитый газ со специфическим запахом. Сероводород является сильным восстановителем (наличие S−2). В водном растворе сероводород ведет себя как слабая двухосновная кислота. Средние соли сероводородной кислоты – сульфиды – в большинства своем не растворимы, за исключением сульфидов щелочных металлов. Большая часть гидросульфидов довольно хорошо растворима, но зачастую известна лишь в растворе. Все сульфиды гидролизуются.
При горении серы образуется оксид серы (IV) или сернистый ангидрид. Оксид серы (IV) – химически довольно активное вещество. При растворении SO2 в воде образуется слабая двухосновная сернистая кислота, которая образует два ряда солей: средние – сульфиты и кислые – гидросульфиты. Практически все гидросульфиты устойчивы только в растворах, а из сульфитов хорошо растворимы соли калия и натрия. Для соединений четырехвалентной серы характерны реакции, связанные с повышением степени окисления: и сернистая кислота и ее соли являются сильными восстановителями. Химические процессы, связанные с понижением степени окисления менее характерны. Сульфиты способны присоединять серу, переходя при этом в соли серноватистой (тиосерной) кислоты.
По силе серноватистая кислота H2S2O3 близка к серной, но в свободном состоянии она неустойчива и распадается (при подкислении растворов) на сернистую кислоту и серу. Соли тиосерной кислоты – тиосульфаты – напротив, устойчивы. Тиосульфаты, как правило, хорошо растворимы. Наибольшее значение имеет тиосульфат натрия, который широко используется как восстановитель.
Окисление оксида серы (IV) кислородом в присутствии катализаторов приводит к образованию серного ангидрида (оксида серы (VI)). Оксид серы (VI) характеризуется сильными окислительными свойствами, с другой стороны, он является кислотным оксидом, который при взаимодействии с водой образует серную кислоту.
Реакционная способность серной кислоты зависит от ее концентрации. Разбавленная серная кислота окисляет за счет катиона водорода H+. Поэтому она взаимодействует только с металлами, находящимися в ряду напряжений до водорода
Концентрированная серная кислота является довольно сильным окислителем (за счет S+6). Она окисляет все металлы до серебра включительно. Продукты восстановления зависят от активности метала, концентрации кислоты, температуры. При реакции с малоактивными металлами образуется SO2, при реакции с активными металлами – сера или сероводород. Следует отметить, что концентрированная серная кислота не реагирует с железом, в отличие от кислоты разбавленной. Концентрированная серная кислота является сильным водоотнимающим агентом. Этим свойством объясняется ее способность обугливать углеводороды: воду вытягивает концентрированная серная кислота, а углеродный скелет – остается. Как сильная двухосновная кислота H2SO4 дает два ряда солей: средние и кислые. Кислые соли существуют, в основном, в растворенном виде; большинство сульфатов хорошо кристаллизуется и легко растворимо в воде, за немногим исключением.
Выполнение работы
Реакции сульфид-иона S2−
Опыт 1. Восстановительные свойства сульфида. Прибавляйте по каплям сульфид натрия до полного изменения окраски: а) к 3–4 каплям бромной воды; б) к 2–3 каплям иодной воды; в) к 1–2 каплям раствора перманганата калия; г) к 1–2 каплям раствора перманганата калия, подкисленного несколькими каплями разбавленной серной кислоты; д) к 1–2 каплям раствора дихромата калия подкисленного несколькими каплями разбавленной серной кислоты; е) к 3–4 каплям хлорида железа (III). В каждом отдельном опыте отметьте изменение окраски окислителя, а также помутнения раствора.
