Опыт 3. карбонат и гидрокарбонат натрия
А. Реакция среды в растворе карбоната и гидрокарбоната натрия. В три пробирки налить: дистиллированную воду, 5 капель карбоната натрия, 5 капель гидрокарбоната натрия. К каждому раствору добавить по 3 капли фенолфталеина.Какая среда и почему а) в растворе карбоната натрия; б) в растворе гидрокарбоната. Написать ионные и молекулярные уравнения реакций. Почему оттенок окраски фенолфталеина в растворах этих солей различен?
Б. Термическое разложение гидрокарбоната натрия Поместить в тигель или фарфоровую чашечку 3–4 микрошпателя порошка гидрокарбоната натрия и прокаливать содержимое пламенем горелки в течение 10–15 мин. Охладить тигель на воздухе, внести в него 12–14 капель дистиллированной воды, перемешать стеклянной палочкой. Разделить раствор на две пробирки. Доказать, что в растворе находится соль угольной кислоты. Для этого в одну из пробирок добавить 3–4 капли 2 н. раствора хлороводородной кислоты и наблюдать выделение пузырьков газа. Какой газ выделяется? В другую пробирку к полученному раствору прибавить такое же количество раствора фенолфталеина. Сравнить окраску фенолфталеина в данном растворе с окраской растворов в контрольных пробирках, оставшихся после предыдущего опыта. По окраске индикатора определить, какая соль находится в растворе: карбонат натрия или гидрокарбонат?
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Уравнения реакций в молекулярной и ионной форме, результаты проведения реакций, ответы на вопросы. Написать уравнение реакции разложения гидрокарбоната натрия при нагревании. Эта реакция применяется в промышленном способе получения кальцинированной соды.
Лабораторная работа № 2. Свойства элементов II А группы
Цель работы: изучение химических свойств элементов II А .группы.
Общие сведения
Во II А группу входят элементы бериллий, магний, кальций, стронций, барий и радий. Все элементы, кроме бериллия, обладают ярко выраженными металлическими свойствами. Бериллий и магний занимают в группе особое положение. Бериллий относится к амфотерным элементам, проявляя сходство с алюминием (диагональное сходство). При растворении гидроксида бериллия в щелочах образуется комплексный анион тетрагидроксобериллия. Гидроксид бериллия, как и гидроксид магния, являются слабыми основаниями. Магний проявляет чисто основные свойства. Собственно щелочно-земельными являются только три элемента: кальций, стронций и барий.
В отношении химической активности элементы II А группы подобно щелочным металлам быстро окисляются на воздухе (до оксида), могут вытеснять водород из воды. Однако бериллий и магний реагируют с водой медленно из-за образования на поверхности металла малорастворимого гидроксида.
Оксиды кальция, стронция и бария непосредственно соединяются с водой, образуя гидроксиды. Растворимость гидроксидов увеличивается от Ca к Ba. В этой же последовательности растут основные свойства гидроксидов.
Многие из солей щелочноземельных металлов мало растворимы в воде. Растворимость солей с одноименным анионом, например, сульфатов, уменьшается сверху вниз по всей II А группе.
Выполнение работы
Опыт 1. Окрашивание пламени горелки. В пламя горелки последовательно вести по капле солей кальция, стронция, бария.
Опыт 2. Образование карбонатов. В 3 пробирки налить по 3-4 капли сульфата магния, хлоридов кальция, стронция и бария. В 4-ю пробирку налить 3–4 капли сульфата магния и 4–5 капель хлорида аммония. Во все пробирки прибавить раствор соды. При необходимости нагреть. Записать наблюдения (в присутствии хлорида аммония осадок основного карбоната магния образоваться не должен).
К осадку карбоната бария добавить немного соляной кислоты. Почему происходит растворение карбоната бария в соляной кислоте?
Опыт 3. Образование труднорастворимого фосфата аммония, магния (качественная реакция). К 2-м каплям раствора соли магния добавить раствор хлорида аммония, 2 капли гидроортофосфата натрия и гидроксид аммония (2 н.) до рН » 9 (по каплям, при перемешивании и измерении рН после добавления каждой капли). Если белый кристаллический осадок не образуется, то необходимо добавить 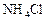 и потереть внутренние стенки пробирки стеклянной палочкой.
и потереть внутренние стенки пробирки стеклянной палочкой.
Ионное уравнение реакции:
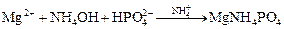 .
.
Гидроксид аммония дает щелочную среду, необходимую для протекания реакции, а соль аммония – ионы аммония для образования двойной соли фосфата аммония, магния.
Опыт 4. Осаждение гидроксида магния. К 3–4 каплям 5 %-ного раствора сульфата магния прилить 5–7 капель 5 %-ного раствора аммиака. Если осадка не образуется – то добавить несколько капель 5 %-ного раствора щелочи. Почему одного гидроксида аммония бывает недостаточно для образования осадка гидроокиси магния? Провести эту же реакцию в присутствии избытка хлористого аммония. Будет ли образовываться осадок гидроксида магния? Если нет, то почему?
