Опыт 2. Осаждение марганца (II)
А. Отобрать в пробирку 3–4 капли раствора соли марганца (II) и добавить 3–4 капли раствора карбоната натрия (или карбоната аммония). Образуется белый осадок, содержащий MnCO3. При стоянии на воздухе осадок потемнент из-за частичного окисления марганца (II) до марганца (IV).
Б. В две пробирки отобрать равный объем сульфида аммония. К одной пробе прибавить 2–3 капли раствора аммиака, другую подкислить 2 каплями разбавленной соляной кислоты. К содержимому пробирок прибавить 3–4 капли раствора сульфата марганца (II). В кислой среде образование сульфида не идет, т.к. концентрация ионов S2− оказывается не достаточной для достижения произведения растворимости MnS.
В. К раствору соли марганца (II) прибавить несколько капель раствора дигидроортофосфата натрия и немного аммиака. К полученному осадку Mn(NH4)PO4·H2O прибавить несколько капель перекиси водорода. Осадок приобретет темный цвет. Почему?
Опыт 3. Окисление Mn (II). К двум каплям раствора соли марганца (II) прибавить 2 мл 6 н. раствора азотной кислоты и немного твердого висмутата натрия (на кончике шпателя). Смесь перемешать. При этом образуется раствор марганцевой кислоты розового цвета:
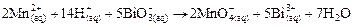 .
.
Опыт 4. Окислительные и восстановительные свойства соединений марганца (IV).
А. Окислительные свойства диоксида марганца. В пробирку поместить диоксида марганца и 2–3 капли концентрированной соляной кислоты (d = 1,19 г/см3). По цвету и запаху определить, какой газ выделяется. Если реакция идет недостаточно энергично, пробирку осторожно подогреть маленьким пламенем горелки.
Б. Восстановительные свойства диоксида марганца. В тигель положить по небольшому кусочку твердого едкого натра (брать пинцетом) и кристаллического нитрата калия. Тигель поставить на сетку или в фарфоровый треугольник и нагреть пламенем горелки до расплавления смеси (осторожно!). Не прекращая нагревания, добавить в расплав очень немного (на кончике шпателя) диоксида марганца и продолжать нагревание, пока масса не загустеет. Отметить окраску полученного расплава и сохранить его для опыта. Написать уравнение реакции окисления диоксида марганца нитратом калия в щелочной среде до Na2MnO4. В какое соединение перешел нитрат калия?
Опыт 5. Окислительные свойства перманганата калия.
А. Кислая среда. В три пробирки налить по 1–2 капли раствора перманганата калия и добавить столько же 2 н. серной кислоты. В первую пробирку добавить 5 капель раствора йодида калия, во вторую – столько же раствора сульфата железа (II), в третью – столько же раствора сульфита натрия.
Б. Нейтральная среда. В две пробирки налить по 3 капли раствора перманганата калия; в первую пробирку добавить столько же раствора сульфита натрия, во вторую – раствора сульфата марганца (II).
В. Сильнощелочная среда. В пробирку налить три капли раствора перманганата калия, столько же раствора щелочи и 3–4 капли раствора сульфита натрия.
Отметить изменение окраски растворов во всех пробирках. Установить, в какой среде окислительные свойства перманганата калия выше.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Уравнения реакций в молекулярной и ионной форме, результаты проведения реакций, ответы на вопросы.
Лабораторная работа № 13. VIII В группа. Подгруппа железа
Цель работы: изучение химических свойств элементов подгруппы железа.
Общие сведения
Восьмая группа побочная подгруппа включает три группы элементов, по три элемента в каждой, которые расположены друг за другом: железо – кобальт – никель; рутений – родий – палладий и осмий – иридий – платина. Три первых элемента по химическим свойствам чрезвычайно близки между собой, их объединяют в подгруппу железа. Остальные шесть элементов составляют металлы платиновой группы МПГ, которые по сходству свойств делят на три двойки: рутений + осмий, родий + иридий и платина + палладий.
Общими свойствами всех элементов являются: металлический характер; цвет в металлическом состоянии – серый; тугоплавкость; малый атомный объем; адсорбция водорода; каталитическая активность; способность проявлять различные валентные состояния и легкость перехода между степенями окисления; отличные комплексообразователи; образуют окрашенные соединения; гидроксиды обладают либо основным либо слабо амфотерным характером; активность металла в тройках убывает слева направо; образование прочных сульфидов.
По химическим свойствам железо, кобальт и никель являются металлами средней активности. В отсутствие воды при обычных условиях металлы подгруппы железа слабо взаимодействуют с типичными неметаллами, такими как кислород, сера, хлор, бром. В ряду напряжений все три металла находятся до водорода в последовательности Fe – Co – Ni, соответственно все три элемента растворяются в кислотах. Со щелочами не реагируют. По отношению к воздуху элементы подгруппы железа проявляют устойчивость в отсутствии воды.
Устойчивыми валентными состояниями являются II и III. Двухвалентное состояние характерно для всех элементов. Для железа более стабильным является трехвалентное состояние. Кобальт и никель проявляют степень окисления +3 в составе комплексных соединений.
Оксиды двухвалентных металлов имеют общую формулу MeO, практически не растворимы в воде, носят чисто основной характер. Гидроксиды состава Ме(ОН)2 относятся к классу слабых оснований. Гидроксид железа (II) во влажной атмосфере легко окисляется кислородом воздуха до Fe(OH)3. Гидратированные ионы Me2+ окрашены. Катион Fe2+ не устойчив и легко окисляется до Fe3+.
Оксид железа (III) может быть получен при непосредственном взаимодействии простых веществ. Для кобальта и никеля такой процесс не характерен. Гидроксиды состава Ме(ОН)3 могут быть получены для всех трех элементов действием щелочи на соответствующие соли. Имеют основной характер.
Отличительной особенностью кобальта и никеля является способность образовывать аммиачные комплексы как в двух- так и в трехвалентном состоянии. Для железа образование комплексов с аммиаком возможно только в двухвалентном состоянии.
Выполнение работы
Опыт 1. Образование осадков гидроксидов. В 4 пробирки налить по 3–4 капли растворов сульфата железа (II), хлорида железа (III), сульфата никеля и сульфата кобальта. К каждой пробирке прибавить по нескольку капель раствора щелочи. К образовавшимся осадкам гидроксидов прибавить разбавленную соляную кислоту до их растворения.
Опыт 2. Образование аммиачных комплексов металлов. В 3 пробирки отобрать по 3–4 капли растворов сульфата железа (II), сульфата никеля и сульфата кобальта. Прибавить к каждой пробирке по несколько капель раствора гидроксида аммония до образования осадков. Растворить осадки в избытке аммиака (в присутствии NH4Cl).
Опыт 3. Образование и свойства сульфидов. В 3 пробирки отобрать по 3–4 капли растворов сульфата железа (II), сульфата никеля и сульфата кобальта. Прибавить к каждой пробирке по несколько капель раствора соляной (или разбавленной серной) кислоты и раствор сульфида натрия до образования осадков. На полученные осадки сульфидов подействовать 20 %-ной соляной кислотой (должен раствориться только FeS).
Опыт 4. Окисление Fe (II) в Fe (III). В одну пробирку налить 4–5 капель бромной воды, во вторую – 2 капли раствора перманганата калия. Добавить в каждую пробирку по две капли 20 %-ной серной кислоты и прилить по 3–4 капли раствора сульфата железа (II). Отметить обесцвечивание растворов. Убедиться в образовании ионов Fe3+ с помощью качественной реакции с тиоцианатом аммония, при добавлении которого должен образоваться растворимый комплекс красного цвета.
