Определение энтальпии растворения соли (кислоты или основания)
Работа выполняется двумя студентами. Получить у преподавателя соль, энтальпию растворения которой нужно определить (при определении энтальпии растворения кислоты или основания необходимо соблюдать технику безопасности). Для определения энтальпии растворения соли используется калориметр, схема которого показана на рисунке.
Калориметр состоит из двух стаканов, из которых наружный стакан 1 имеет емкость 500 мл, а внутренний 2– 250 мл. Для уменьшения теплоотдачи внутренний стакан ставится на корковую пробку. В картонную крышку, закрывающую внешний стакан, вставляют термометр 3 с делениями в 0,1°С и стеклянную или проволочную мешалку 4. В крышке калориметра имеется отверстие для внесения навески соли, закрытое пробкой 5.
Для опыта используют соли, хорошо растворимые в воде и имеющие энтальпию растворения не менее 20 кДж/моль. В качестве таких солей можно использовать KNO3, NH4NO3, Na2CO3×10H2O, Na2SO4×10H2O, CaCl2, CuSO4, NaCO3.
Во взвешенный внутренний стакан калориметра налить с помощью бюретки точный объем дистиллированной воды (50 мл) и через 5 минут при перемешивании воды измерить ее температуру с точностью до 0,05°С. Затем через отверстие в крышке калориметра внести точную навеску растертой в фарфоровой ступке соли, соответствующую примерно 0,01 моль вещества (навеску ссыпать с кальки через сухую воронку). Быстро закрыть отверстие с пробкой, перемешивать раствор до полного растворения соли и одновременно через каждые 5 с снимать показания термометра до установления начальной температуры опыта (температуры воды). Из полученной зависимости температура – время определить самую низкую (высокую) температуру, достигнутую при растворении соли в воде. Результаты опыта записать по предложенной форме.
| Данные опыта | Номер опыта | |
| Масса внутреннего стакана m1, г | ||
| Масса воды, г | ||
| Масса соли m2, г | ||
| Температура воды, t1,°С | ||
| Минимальная (максимальная) температура раствора t2,°С | ||
| Удельная теплоемкость раствора (1 моль соли на 185 – 200 моль воды) Сp, Дж/град×г | ||
| Удельная теплоемкость стекла Сp’, Дж/град×г | 0,92 | |
| Разность между конечной и начальной температурой опыта Dt = t2 - t1,°С | ||
| Количество теплоты, поглощенной стеклом стакана и термометра q, Дж | ||
| Масса раствора (вода + m2), г |
Значение теплоемкости водного раствора соответствующей соли найти в справочной литературе (Справочник Химика, Т. 3. М.; Л.: Химия, 1964, С. 637). В этом же справочнике приводятся энтальпии растворения многих неорганических веществ (С. 612 – 634).
Энтальпию растворения соли вычислить по уравнению
DHраств = - 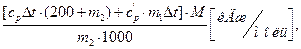
где M – молярная масса растворенного вещества; m1 –масса внутреннего стакана.
Полученные результаты сравнить с литературными данными (табл. 1) по энтальпиям растворения солей, кислот и оснований (200С).
Т а б л и ц а 1
| Вещество | Число молей H2O на 1 моль вещества | Энтальпия растворения, кДж/моль | Теплоемкость раствора, Дж/град×г |
| NH4NO3 | 26,50 | 4,09 | |
| NH4Cl | 16,40 | 4,11 | |
| KNO3 | 35,36 | 4,04 | |
| NaNO3 | 20,94 | 4,08 | |
| K2SO4 | 27,38 | 3,96 | |
| Na2CO3 | -23,58 | 4,06 | |
| Na2CO3×10H2O | 67,55 | 4,06 | |
| Na2SO4 | -2,30 | 4,13 | |
| Na2SO4×10H2O | 78,42 | 4,13 | |
| Na2HPO4 | -23,58 | 4,03 | |
| Na2HPO4×12H2O | 95,43 | 4,03 | |
| CaCl2 | -75,20 | 4,00 | |
| CaCl2×6H2O | 19,06 | 4,00 | |
| CuSO4 | -66,42 | 3,98 | |
| CuSO4×5H2O | 11,91 | 3,98 | |
| ZnSO4 | -77,04 | 4,05 | |
| ZnSO4×7H2O | 17,81 | 4,05 | |
| HCl | -77,08 | 4,13 | |
| H2SO4 | -74,20 | 4,14 | |
| HNO3 | -31,27 | 4,14 | |
| KOH | -55,55 | 4,08 | |
| NaOH | -41,55 | 4,12 |
Определите ошибку опыта в процентах.
ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ
1. Сформулируйте закон Гесса и следствия;
2. Объясните с позиции термодинамики возможность эндотермичного самопроизвольного растворения хлорида аммония.
3. Почему растворение сульфата меди в аммиачном растворе более экзотермично, чем в чистой воде? Как из этих тепловых эффектов можно определить теплоту комплексообразования?
4. Почему для определения теплоты растворения следует брать обязательно большой избыток растворителя?
5. Почему теплота нейтрализации в растворах сильных кислот и оснований приблизительно одинаковы, а в растворах слабых электролитов заметно различается? От чего это зависит?
6. Определите температуру раствора, образованного смешением 3г рас-твора CaCl2 и 200г воды. Данные для расчетов возьмите из таблицы 1.
7. Определите энтальпию растворения тиосульфата натрия, если масса соли равна 4г, масса воды- 150г, начальная температура- 22,3°С, конечная- 22,7°С, теплоемкость раствора- 4,04 Дж/г×град.
Лабораторная работа № 4
Обратимые и необратимые реакции.
Химическое равновесие
Некоторые химические реакциимогут протекать в двух взаимно противоположных направлениях. Такие реакции называются обратимыми. Обратимость химических реакций записывается следующим образом:
А + В Û В
При протекании химической реакции концентрации исходных веществ уменьшаются в соответствии с законом действия масс. Это приводит к уменьшению скорости прямой реакции. Если реакция обратима, т.е. может протекать как в прямом, так и в обратном направлениях, то с течением времени скорость обратной реакции будет возрастать, т.к. увеличиваются концентрации продуктов реакции.
Когда скорости прямой и обратной реакции становятся одинаковыми, наступает состояние химического равновесия, и дальнейшего изменения концентрации участвующих в реакции веществ не происходит.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия.
В случае обратимой химической реакции, например:
N2 + 3H2 Û 2NH3
зависимость скоростей прямой ( 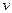 пр) и обратной (
пр) и обратной ( 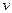 обр) реакций от концентраций реагирующих веществ выражаются отношениями:
обр) реакций от концентраций реагирующих веществ выражаются отношениями:
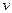 пр = Кпр ´ [N2] ´ [Н2]3;
пр = Кпр ´ [N2] ´ [Н2]3;
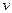 обр =Кобр ´ [NH3]2.
обр =Кобр ´ [NH3]2.
В состоянии химического равновесия: 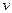 пр =
пр = 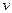 обр, т.е.
обр, т.е.
Кпр * [N2] * [Н2]3 = Кобр * [NH3]2
Или 
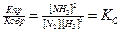
где Кс - константа равновесия реакции.
Константа равновесия (Кс)при данной температуре - величина, показывающая то соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которые устанавливаются при равновесии. Величина константы равновесия зависит от природы реагирующих веществ и от температуры, а от катализаторов и изменения концентрации веществ не зависит.
