Очная форма обучения (3 курс 5 семестр)
УТВЕРЖДАЮ
Зав. кафедрой ФАХП ВолгГТУ
академик РАН ________ И.А. Новаков
«____» ___________ 2012 г.
ВОПРОСЫ К ЗАЧЕТУ ПО ДИСЦИПЛИНЕ «ФИЗИЧЕСКАЯ ХИМИЯ»
НАПРАВЛЕНИЕ: 240100.62 «ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ»
очная форма обучения (3 курс 5 семестр)
1. Химическая термодинамика. Основные понятия и определения (система, круговые и некруговые процессы, внутренняя энергия, теплота и работа).
2. I закон термодинамики. Приложение I закона термодинамики для расчета теплоемкости. Взаимосвязь Ср и Сv. Теплоемкость газов, твердых веществ и жидкостей. Правило Дюлонга и Пти и Коппа-Неймана. Зависимость теплоемкости от температуры.
3. Термохимия. Тепловой эффект химической реакции. Закон Гесса. Применение закона Гесса к расчету тепловых эффектов. Следствия из закона Гесса. Термохимическое уравнение. Связь между тепловыми эффектами при Р=const и V = сonst.
4. Зависимость теплового эффекта химической реакции от температуры. Уравнение Кирхгофа в дифференциальной форме (вывод). Анализ графической зависимости теплового эффекта химической реакции от температуры. Уравнение Кирхгофа в интегральной форме. Расчет тепловых эффектов химических реакций с помощью трех приближений.
5. II закон термодинамики. Понятие равновесного и неравновесного процесса. Обратимый процесс. Цикл Карно и математическое выражение второго закона термодинамики.
6. II закон термодинамики Самопроизвольные и не самопроизвольные процессы. Фундаментальное уравнение термодинамики. Изменение энтропии в неравновесных (необратимых) процессах. Изменение энтропии как критерий направленности и равновесия в изолированной системе.
7. II закон термодинамики. Самопроизвольные и не самопроизвольные процессы. Фундаментальное уравнение термодинамики. Изменение энтропии как критерий направленности и равновесия в изолированной системе. Расчет изменения энтропии в различных процессах.
8. Характеристические функции и их значение. Изохорно-изотермический потенциал. Функциональная зависимость изохорно-изотермического потенциала. Уравнение Гиббса-Гельмгольца. Зависимость свободной энергии Гельмгольца от объема при Т=соnst. Направление и условия равновесия процесса при постоянстве объема и температуры.
9. Характеристические функции и их значение. Изобарно-изотермический потенциал. Функциональная зависимость изобарно-изотермического потенциала. Уравнение Гиббса-Гельмгольца. Зависимость свободной энергии Гиббса от давления при Т=соnst. Направление и условия равновесия процесса при постоянстве давления и температуры.
10. Равновесие химических реакций. Условия равновесия химических систем (вывод). Химический потенциал. Зависимость химического потенциала от давления и концентрации.
11. Равновесие гомогенных химических реакций. Константа равновесия (вывод). Взаимосвязь констант равновесия химических реакций. Принцип Гиббса–Ле Шателье.
12. Химическое равновесие. Константа равновесия. Равновесие гомогенных газовых реакций, протекающих с изменением числа молей.
13. Химическое равновесие. Константа равновесия. Равновесие гомогенных газовых реакций, протекающих без изменения числа молей.
14. Особенности химического равновесия гетерогенных реакций. Равновесие гетерогенных химических реакций, протекающих без изменения числа молей.
15. Особенности химического равновесия гетерогенных реакций. Равновесие гетерогенных реакций, протекающих с изменением числа молей газообразных участников реакции.
16. Максимальная полезная работа как мера химического сродства. Уравнение изотермы Вант-Гоффа (вывод).
17. Зависимость константы равновесия от температуры. Уравнение изобары и изохоры Вант-Гоффа. Зависимость константы равновесия реакций, протекающих в газообразной фазе от давления.
18. III закон термодинамики. Следствия. Определение абсолютного значения энтропии. Расчет изменения стандартной энергии Гиббса методом абсолютных энтропий и методом Темкина-Шварцмана
19. Термодинамические уравнения состояния. Понятие о летучести и активности.
20. Фазовые равновесия. Основные понятия. Условия фазового равновесия. Правило фаз Гиббса. Классификация систем.
21. Правило фаз Гиббса (вывод). Применение правила фаз и уравнения Клапейрона-Клаузиуса к гетерогенной однокомпонентной системе.
22. Двухкомпонентные гетерогенные системы. Диаграммы плавкости и анализ их с помощью правила фаз Гиббса.
23. Трехкомпонентные системы. Ограниченная взаимная растворимость трех жидкостей.
24. Фазовые переходы. Уравнение Клайперона-Клаузиуса (вывод). Зависимость давления насыщенного пара от температуры. Определение теплоты испарения. Правило Трутона.
25. Фазовые переходы. Уравнение Клапейрона-Клаузиуса. Применение его для анализа диаграммы состояния однокомпонентной системы.
26. Учение о растворах, Природа растворов. Классификация растворов. Энергетические изменения при образовании растворов.
27. Разбавленные растворы. Растворимость газов в жидкостях, закон Генри и его особенности.
28. Свойства бесконечно разбавленных растворов. Понижение давления пара растворителя над раствором. Закон Рауля. Повышение температуры кипения растворов. Эбулиоскопия.
29. Свойства бесконечно разбавленных растворов. Понижение температуры замерзания растворов. Вывод уравнения зависимости 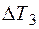 =
= 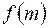 Криоскопия.
Криоскопия.
30. Свойства бесконечно разбавленных растворов. Осмотическое давление. Зависимость осмотического давления от концентрации растворителя и растворенного вещества. Уравнение Вант-Гоффа.
31. Концентрированные растворы. Идеальные растворы, давление насыщенного пара над ними. Растворы с положительными и отрицательными отклонениями от закона Рауля. Состав парообразной фазы.
32. Состав парообразной фазы. Законы Коновалова. Соотношение между составом жидкой и парообразной фаз.
33. Перегонка растворов. Перегонка в равновесии. Фракционная перегонка. Ректификация.
34. Перегонка растворов. Фракционная перегонка растворов с большими положительными и отрицательными отклонениями от закона Рауля.
35. Растворы с ограниченной взаимной растворимостью компонентов. Критическая температура. Правило Алексеева.
36. Распределение вещества между двумя несмешивающимися жидкостями. Экстракция из раствора.
