| | Характеристика элементов | |
| | Br, I ─ p-элементы: …4s24p5 (…5s25p5) | |
| | Br, I ─ неметаллы (галогены) |
| | Валентность: | I , III , V, VII |
| | Степени окисления: | – 1, 0, +1, +3, +5, +7 | | | | | | |
| | Нахождение в природе |
| | Бром сопутствует хлору в его калийных минералах. Иод (в виде солей KIO3 и KIO4) сопутствует залежам нитрата натрия (селитры) и встречается в виде минерала лаутарита (NaIO3) . Бромиды и иодиды содержатся в морской воде. Иод содержится в некоторых морских водорослях, зола которых используется для получения I2 по следующей химической схеме: |
| | I− (зола) + MnO2 + Н2SО4 ¾® I2 + H2O + MnSО4 |
| | | | | | | | | | | |
| | I. Br2, I2 – простые вещества |
| | | Бром – красно-коричневая летучая жидкость; иод – черно-фиолетовые кристаллы. |
| | | Мало растворимы в воде: в 100 г воды при 20 0С растворяется 3,5 г брома и 0,02 г иода. Водные растворы называются бромной и иодной водой, соответственно. |
| | | Хорошо растворяются в органических растворителях, в частности, в хлороформе (СНCl3) и четыреххлористом углероде (СCl4), бром – с образованием золотисто-желтого раствора, иод – малинового. |
| | | |
| | Различия в химической активности галогенов определяются тем, что в ряду Cl2 ¾¾ Br2 ¾¾ I2 |
| 1. | ослабевают окислительные свойства галогенов, и реакции с бромом как с окислителем протекают менее энергично, чем с хлором, |
| | а с иодом – еще менее, чем с бромом; |
| 2. | усиливаются их восстановительные свойства. Хлор (за исключением реакций самоокисления- самовостановления) восстановителем не является, тогда как бром уже может проявлять восстановительные свойства: |
| | а) | Br2 + 5Cl2 + + 6Н2О ¾¾® 2HBrО3 +10HCl |
| | | которые в большей степени характерны для иода: |
| | б) | I2 + 5Cl2 + 6Н2О ¾¾® 2HIО3 + 10HCl | I2 + 5Н2О2 ¾ H2SO4¾® 2HIО3 + 4Н2О | |
| | | I2 + 5Br2 + 12KOH ¾¾® 2KIО3 + 10KBr + 6Н2О | 3I2 +10HNO3(конц.) ¾¾® 6HIО3 + 10NO + 2Н2О | |
| | | Ослабление окислительных свойств (см. 1) приводит, в частности, к тому, что |
| 3. | | в отличие от Cl2 и Br2, которые окисляют … |
| | а) | … железо до солей железа(III): |
| | | Fe + Cl2 ¾® FeCl3, | | Fe + Br2 ¾® FeBr3, | | |
| | | I2 – только до солей железа(II): |
| | | Fe + I2 ¾® FeI2 | | | | |
| | б) | … фосфор до галогенидов Р(V): PCl5, PBr5 |
| | | I2 образует иодид только Р(III): PI3 |
| | | |
| 4. | | Взаимодействие с Н2 |
| | | В отличие от хлора, бром и иод взаимодействуют с водородом при высоких температурах, причем обратимо: Н2 + Br2 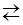 2НBr 2НBr |
| | | При этом в случае I2 равновесие настолько смещено в сторону исходных соединений (влево), что можно считать, что реакция практически не идет. |
| 5. | | Диспропорционирование |
| | а) | В водной среде |
| | | на холоду в случае брома равновесие: | | при нагревании: |
| | | Br2 + Н2О 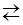 HBr + HOBr (бромноватистая кислота) HBr + HOBr (бромноватистая кислота) | | 3Br2 + 3Н2О ¾¾® 5HBr + HBrО3 (бромноватая кислота) |
| | | значительно смещено в сторону исходных соединений, а иод практически не диспропорционирует. |
| | б) | При растворении в водных растворах щелочей они ведут себя подобно хлору () |
| | | На холоду (см. примечание в III-A-3): | | При нагревании: |
| | | Br2 + NaOH ¾¾® Н2О + NaBr + NaBrO | | 3Br2 + 6КOH ¾¾® 3Н2О + 5КBr + КBrО3 |
| | | | гипобромит натрия | | | бромат калия |
| | | I + NaOH ¾¾® Н2О + NaI + NaIO | | 3I2 + 6КOH ¾¾® 3Н2О + 5КI + КIО3 |
| | | | гипоиодит натрия | | | иодат калия |
| | | |
| | | | | | | | |
| | | |
| 6. | | Бром и иод окисляют … |
| | а) | …серу в степени окисления –2 до степени окисления 0 (см. тему «Химия серы»): |
| | | H2S + I2 ¾¾® S↓ + 2HI | Na2S + Br2 ¾¾® S↓ + 2NaBr |
| | б) | …серу в степени окисления +4 (до +6): |
| | | SО2 + I2 + 2Н2О ¾¾® Н2SО4 + 2HI | Na2SО3 + Br2 + NaOH ¾¾® Na2SО4 + 2NaBr |
| | | | | | |
| 7. | | Бром окисляет |
| | а) | …иодиды: |
| | | 2KI + Br2 ¾¾® 2KBr + I2 |
| | б) | …соли железа(II): |
| | | 2FeBr2 + Br2 ¾¾® 2FeBr3 |
| | в) | … соединения хрома(III) (см. тему «Химия хрома»), в частности: |
| | | 2KCrO2 + 3Br2 + 8KOH ¾¾® 4H2O + 2К2CrO4 + 6КBr |
| 8. | | Получение Br2 | |
| | а) | В промышленности – из бромида калия с использованием хлора как окислителя: | |
| | | 2KBr + Cl2 ¾¾® 2KCl + Br2 | |
| | | В лаборатории – из кислоты HBr (или ее соли в кислой среде) с использованием окислителей KMnО4, MnО2, KClO3: | |
| | б) | 2KMnО4 + 16НBr ¾¾® 5Br2 + 8H2О + 2MnBr2 + 2КBr | | MnО2 + 4НCl (конц.) ¾¾® Cl2↑ + 2H2О + MnCl2 |
| | в) | MnО2 + 4НBr ¾¾® Br2 + 2H2О + MnBr2 | г) | KClO3 + 6HBr ¾¾® 3Br2 + 3H2O + KBr | |
| | | | | | | |
| 9. | | Получение I2 |
| | а) | В промышленности – из иодида калия с использованием хлора как окислителя: |
| | | 2KI + Cl2 ¾¾® 2KCl + I2 |
| | | В лаборатории – из кислоты НI (или ее соли) с использованием окислителей KMnО4, MnО2, KClO3, KBrO3, FeCl3, CuSO4: |
| | б) | KBrO3 + 6HI ¾¾® I2 + 3H2O + КBr | г) | 2CuSO4 + 4HI ¾¾® I2 + 2CuI↓ + 2H2SO4 |
| | в) | 2FeCl3 + 2HI ¾¾® I2 + 2FeCl2 + 2HCl |
| | | |
| 10. | | Качественная реакция на I2 |
| | | I2 образует с крахмалом комплекс, который обусловливает интенсивно синюю окраску раствора крахмала в присутствии иода. |
Наши рекомендации
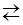 2НBr
2НBr 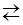 HBr + HOBr (бромноватистая кислота)
HBr + HOBr (бромноватистая кислота) 