Основные определения и термины. Все жизненные процессы в живом организме протекают нормально при постоянном
Все жизненные процессы в живом организме протекают нормально при постоянном количестве ионов водорода (рН). Поэтому там, где должно сохраниться одно и то же значение рН, необходимо наличие буферных систем (работа ферментов и гормонов, изменение количества ионов водорода в крови и лимфотканевых жидкостях влияют на осмотическое давление). Буферные системы – это растворы солей, соли и кислоты или соли и щелочи, т.е. так называемые кислотно-основные, обладающие способностью почти не изменять свой водородный показатель при разбавлении, добавлении кислоты или щелочи в количестве, не превышающем некоторого предела.
Простейшие буферные растворы можно разделить на два основных типа: первый – смесь слабой кислоты и ее соли, имеющей с этой кислотой общий анион (например, ацетатный буферный раствор, состоящий из уксусной кислоты СН3СООН и ацетата натрия СН3CООNa), второй – смесь основания и соли, имеющей с этим основанием общий катион (например, аммиачный буферный раствор, состоящий из гидроксида и хлорида аммония).
К буферным системам можно отнести также смесь, состоящую из растворов двух солей разной основности одной и той же кислоты (например, фосфатная буферная система, состоящая из двухзамещенного и монозамещенного фосфата натрия Na2HPO4 и NaH2PO4).
Центральное место среди таких систем в организме занимает гидрокарбонатная буферная смесь из угольной кислоты и гидрокарбоната натрия (H2CO3 + NaHCO3). Механизм ее действия связан с дыхательной и почечной регуляцией количества ионов Н+ и заключается в связывании избыточных ионов водорода или гидроксила в случае нарушения кислотно-основного баланса в крови. Это возможно за счет диссоциации компонентов гидрокарбонатного буферного раствора, при этом активно возрастает количество ионов водорода по схемам:
H2CO3 ↔ CO2 + H2O,
H2CO3 ↔ H+ + HCO3–,
CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3–,
NaHCO3 ↔ Na+ + HCO3–.
Если в крови в процессе обмена веществ появилось избыточное количество кислых продуктов (НСl) и активно возросло количество ионов водорода
Na+ + HCO3– + HCl ↔ NaCl + H2CO3,
то равновесие последней реакции по принципу Ле Шателье – Брауна будет смещено в сторону образования угольной кислоты и количество ионов Н+ уменьшится вследствие очень низкой степени ее диссоциации. Однако накопление угольной кислоты в крови не происходит, так как она декарбоксилирует на углекислый газ (CO2) и воду. Под действием дыхательных функций легких избыток углекислого газа выводится из организма. При уменьшении количества ионов водорода равновесие реакции
H+ + HCO3– + Na+ + OH- ↔ NaHCO3 + H2O
в соответствии с принципом подвижного равновесия смещается вправо, так как уменьшение количества ионов Н+ повысит диссоциацию угольной кислоты. Количество ионов водорода восстанавливается. При этом концентрация Н2СО3 в крови не уменьшается, так как происходит образование новых молекул угольной кислоты из СО2 и Н2О. Этим самым пополняется запас этой кислоты в системе. Подобный механизм действия характерен для всех буферных систем.
Под контролем центральной нервной системы находится и деятельность почек, также принимающих участие в регуляции рН крови путем выделения с мочой растворимых кислот и оснований.
Способность буферного раствора сохранять постоянным значение рН ограничена буферной емкостью (В). За единицу В принимают емкость такого буферного раствора, для изменения рН которого на единицу требуется введение сильной кислоты или основания в количестве 1 моль эквивалента на 1 л раствора.
Буферная емкость, моль/л, рассчитывается по формуле
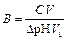 ,
,
где С – молярная концентрация эквивалентов сильной кислоты или основания, моль/л; V – объем добавленного сильного электролита, мл; Vб – объем буферного раствора, мл; DрН – изменение рН буферного раствора.
На практике значение рН буферных растворов определяют методами: а) колориметрическим – по изменению окраски цветных индикаторов; б) электрометрическим или потенциометрическим.
В последнем методе определение рН буферных растворов сводится к измерению ЭДС цепи, составленной из электрода с известным потенциалом – потенциалом электрода сравнения (вспомогательного) и электрода определения (индикаторного):
Е = jинд–jвсп .
Для измерения рН используют электроды, способные закономерно (линейно) отвечать изменениям своего потенциала на активное изменение количества ионов водорода, т.е. на рН. Такие электроды называются индикаторными. К ним относятся: водородный, хингидронный, стеклянный электроды.
Стеклянный электрод является универсальным для определения рН. Количество ионов водорода с использованием стеклянного электрода измеряют на приборах – рН-метрах (рисунок).
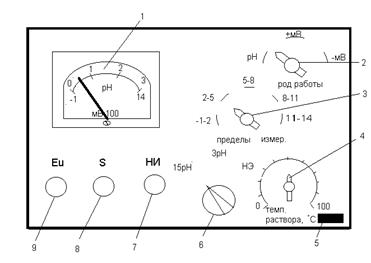
Внешняя панель рН-метра-340:
1 – измерительная шкала; 2 – ручка переключателя «Род работы»;
3 – ручка переключателя «Пределы измерения»; 4 – ручка переключателя
«Температура раствора»; 5 – контрольная лампочка; 6 – ручка
переключателя «Размах»; 7 – ручка для включения прибора в сеть;
8 – (S) – переменный резистор; 9 – (Еu) – переменный резистор
для плавной настройки по буферному раствору
Эти приборы имеют различное оформление, но принцип их работы один и тот же. Рабочим органом рН-метра является гальваническая ячейка, состоящая из стеклянного и хлорсеребряного электрода сравнения.
Схему цепи электродной системы можно записать следующим образом:
j1j2j3j4j5
Ag , AgCl| НС1 (0,1моль/л)½стеклянная ½ исследуемый ½ КС1 (нас)½АgC1, Ag
внутренний ½ мембрана ½ раствор(Н+) |
электрод
стеклянный электрод электрод сравнения
Перед началом работ изучить инструкцию, ознакомиться с прибором и методикой измерения.
Общие указания к работе с прибором рН-340.Прибор предназначен для определения рН от –1 до 14.
1. Перед каждым погружением электрода (предварительно вымоченного в растворе соляной кислоты концентрации 0,1 моль/л в течение не менее 8 ч) в контролируемый раствор, особенно при измерении рН раствора, обладающего малой буферной емкостью, электроды необходимо тщательно промыть дистиллированной водой.
Промывка заключается в многократном погружении электрода, подниманием и опусканием стаканчика с дистиллированной водой. При этом недопустим контакт нижней точки электрода с дном стаканчика.
Удаление избытка воды с нижней поверхности стеклянного электрода допускается только прикладыванием фильтровальной бумаги к этой поверхности.
Обтирать поверхность стеклянного электрода нельзя!
2. С целью обеспечения наибольшей точности измерения рекомендуется переключатель «Размах» устанавливать в положение «3 рН» только на время отсчета в данном диапазоне. Во всех остальных случаях (замена буферного раствора, вымачивание электрода, предварительное определение значения рН в широком диапазоне) переключатель «Размах» должен быть установлен в положение «15 рН».
3. Ручкой температурной компенсации рекомендуется пользоваться в случае измерений рН растворов, имеющих постоянную температуру. При этом ручку «Температура раствора» следует установить на значение температуры контролируемого раствора.
4. Отсчет рН по шкале прибора следует производить после того, как показания примут установившиеся значения. Время установления показаний определяется буферной емкостью и температурой раствора. Обычно время установления показания не превышает 3 минут. При измерении рН сильнокислых и сильнощелочных растворов при значениях температур, близких к 0 °С, или при измерениях рН растворов очень малым объемом, время установления показаний может возрасти до 10 минут.
5. При эксплуатации прибора необходимо иметь в виду, что буферные растворы при многократном применении могут изменять значение рН. Изменение настройки рН-метра может быть обнаружено проверкой прибора по нескольким стандартным буферным растворам.
6. При эксплуатации прибора не следует допускать высыхания стеклянного электрода.
7. По окончании работы с прибором электроды должны оставаться погруженными в воду.
Отсчет показаний в широком диапазоне измерения (–1 до 14) необходимо производить по нижней шкале показывающего прибора, оцифрованной от –1 до 14 рН, при установке переключателя «Размах» в положение «15 рН».
Отсчет показаний на любом из других диапазонов («–1–2»; «2–5»; «5–8»; «8–11»; «11–14») необходимо производить по верхней шкале показывающего прибора, руководствуясь оцифровкой верхней шкалы и положением переключателя «Пределы измерения». Переключатель «Размах» устанавливается в положение «3 рН».
Рекомендуется следующее правило отсчета показаний: измеряемое значение рН = начальное значение рН для данного диапазона (нижний предел измерения) +показания, отсчитанные по верхней шкале показывающего прибора.
Примеры:
1. Переключатель диапазона установлен в положении
«11–14», а стрелка показывающего прибора установилась на значении 1,25. Измеряемое значение рН = 11 + 1,25 = 12,25.
2. Переключатель диапазонов установлен в положении
«–1–2», а стрелка показывающего прибора установилась на значении 1,15. Измеряемое значение рН = -1 + 1,15 = 0,15.
3. Переключатель диапазонов установлен в положении
«5–8», а стрелка показывающего прибора установилась на значении 1,35. Измеряемое значение рН = 5 + 1,35 = 6,35.
