Тема 1.7. Металлы и неметаллы
Типовой пример решения задачи
Пример 1. Вычислите массу осадка, полученного действием раствора, содержащего
Г сульфата меди (II), на раствор, содержащий 10 г гидроксида натрия.
Количества, массы и объемы (для газов) реагентов не всегда берутся стехиометрическими, т.е. в соответствии с уравнением реакции и расчетным уравнением.
Чаще один реагент берется в избытке, а следовательно, другой реагент окажется в недостатке. Избыток реагента вступать в реакцию не будет.
Расчет получаемых количеств, масс и объемов (для газов) продуктов проводят только по реагенту в недостатке.
| Последовательность действий | Пример выполнения действий |
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений | Дано: m(СuSO4)=8г m(NaOH)=10г Найти: m(Cu(OН)2)-? |
| 2.Составьте уравнение химической реакции | Решение: СuSO4 + 2NaOH → Cu(OН)2 + Na2SO4 |
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти» | СuSO4 + 2NaOH → Cu(OН)2 + Na2SO4 |
| 4.Под подчеркнутыми формулами подписать по коэффициентам «моли» | СuSO4 + 2NaOH → Cu(OН)2 + Na2SO4 1 моль 2 моль 1 моль |
| 5.Под формулой вещества, массу которого надо найти поставим х моль | СuSO4 + 2NaOH → Cu(OН)2 + Na2SO4 1 моль 2 моль 1 моль х моль |
| 6.Вычислите количество веществ n, которые записаны в «Дано». | 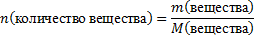 n(СuSO4) = n(СuSO4) = 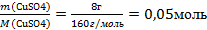 – то, что есть по условию задачи n(NaOH) = – то, что есть по условию задачи n(NaOH) = 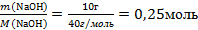 - то, что есть по условию задачи - то, что есть по условию задачи |
| 7.Подпишите найденное n под формулами этих веществ | СuSO4 + 2NaOH → Cu(OН)2 + Na2SO4 1 моль 2 моль 1 моль 0,05 моль 0,25 моль х моль |
| 8. Найдите, какое из исходных веществ СuSO4 или NaOH взято в избытке, составив пропорцию (х можно подставить или под СuSO4 или NaOH) | 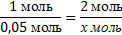 Х= Х= 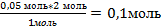 - должно быть NaOH, а его 0,25 моль, значит NaOH дан в избытке. Далее расчет ведем по недостатку, т.е по СuSO4. - должно быть NaOH, а его 0,25 моль, значит NaOH дан в избытке. Далее расчет ведем по недостатку, т.е по СuSO4. |
| 9.Выразим х уже через СuSO4. | СuSO4 + 2NaOH → Cu(OН)2 + Na2SO4 1 моль 2 моль1 моль 0,05 моль 0,25 моль х моль |
| 10.Из полученной пропорции выразить х | 1 моль 1 моль 0,05 моль х моль х = 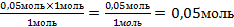 – это количество вещества n(Cu(OН)2) – это количество вещества n(Cu(OН)2) |
| 11.Зная n(Cu(OН)2) найдите массу Cu(OН)2 | m=nM m(Cu(OН)2)= n (Cu(OН)2) 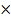 M (Cu(OН)2) M (Cu(OН)2) =64+17 M (Cu(OН)2) M (Cu(OН)2) =64+17  =98г/моль m(Cu(OН)2)=0,05 =98г/моль m(Cu(OН)2)=0,05 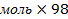 г/моль=4,9г г/моль=4,9г |
| 12.Запишите ответ | Ответ: m(Cu(OН)2)=4,9г |
Контрольные задания
Подготовьте сообщения
1. Коррозия металлов: химическая и электрохимическая. Зависимость скорости коррозии от условий окружающей среды. Классификация коррозии металлов по различным признакам. Способы защиты металлов от коррозии.
2. Производство чугуна и стали. (Указание: что такое чугун, сталь, их получение).
3. Получение неметаллов фракционной перегонкой жидкого воздуха и электролизом растворов или расплавов электролитов. (Указание: на конкретных примерах).
4. Силикатная промышленность.( Указание: сырье, получаемые продукты, их применение).
5. Производство серной кислоты. (Указание: сырье, аппаратура, научные принципы).
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
Задача 1.
1. Рассчитайте массу осадка, которая образуется при сливании растворов, один из которых содержит 260 г нитрата бария, а второй 220 г сульфата калия.
2. К раствору, в котором находится 42,6 г нитрата алюминия, прилили раствор, содержащий 16 г гидроксида натрия. Рассчитайте массу образовавшегося осадка.
3. Какой объём газа (н.у.) выделяется, если к раствору, содержащему 53 г карбоната натрия, прилить раствор, содержащий 80 г азотной кислоты?
4. Рассчитайте, какая масса нитрата магния получится при взаимодействии 20 г оксида магния с раствором, содержащим 94,5 г азотной кислоты.
5. К раствору, содержащему 40 г сульфата меди (II) прибавили 12 г железных опилок. Рассчитайте массу выделившейся меди.
6. Определите массу осадка, которая образуется при сливании раствора, содержащего 0,75 г хлорида бария и раствора, содержащего 0,8 г сульфата натрия.
7. К раствору, в котором находится 20 г сульфата железа (III) прилили раствор, содержащий 6г гидроксида натрия. Вычислить массу образовавшегося осадка.
8. К раствору, содержащему 16 г сульфата меди (II), прибавили 12 г железных опилок. Какая масса меди выделится при этом?
9. Какова масса осадка, образующегося при сливании раствора содержащего 40 г гидроксида натрия с раствором, содержащим 3 моль сульфата меди (II)?
10. Какой объём газа(н.у.) выделится при сливании раствора, содержащего 45 г соляной кислоты с раствором карбоната натрия, содержащим 0,5 моль этой соли?
11. Слили раствор, в котором находится 4 г серной кислоты с раствором нитрата бария, содержащим 2,61 г соли. Рассчитайте массу образовавшегося осадка.
12. 10 г оксида магния обработали раствором, содержащим 40 г азотной кислоты. Какая масса соли образовалась при этом?
13. Рассчитайте массу сульфата бария, образующегося при взаимодействии раствора, содержащего 14 г серной кислоты с раствором хлорида бария, содержащим 2 моль этой соли.
14. Какая масса нитрата цинка образуется при взаимодействии 16,2 г оксида цинка с раствором, содержащим 30 г азотной кислоты?
15. Рассчитайте массу гидроксида меди (II), полученного в результате взаимодействия 8 г гидроксида натрия и 17 г сульфата меди (II).
16. Оксид кальция массой 14 г обработали раствором, содержащим 35 г азотной кислоты. Установите массу образовавшейся соли.
17. Рассчитайте массу серы в реакции 2Н2S+SO2= 3S + 2H2O, если смешано по 11,2 л (н.у.) обоих газов.
18. 8,68 г фосфора сожгли в 10 л (н.у.) кислорода. Определите массу полученного оксида фосфора (V).
19. Реагируют 17,6 г меди и 17,6 г серы. Установите массу продукта – сульфида меди (II).
20. Серная кислота массой 49 г полностью прореагировала с 20 г гидроксида натрия. Какая масса соли при этом образовалась?
21.
22. Какой объем (н.у.) углекислого газа выделится при действии раствора, содержащего 30 г соляной кислоты, на 25 г карбоната кальция?
23. Вычислите массу соли, получающуюся при действии на 5,35 г гидроксида железа (III) раствором, содержащим 10 г азотной кислоты.
24. На 47 г оксида кальция подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата кальция.
25. На 24 г металлического магния подействовали раствором, содержащим 30 г соляной кислоты. Вычислите объем (н.у.) образовавшегося водорода.
26. На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося сульфида алюминия.
27. На раствор, содержащий 53 г карбоната натрия, подействовали раствором, содержащим 49 г серной кислоты. Вычислите массу образовавшейся соли.
28. 40 г оксида алюминия реагирует с раствором, содержащим 20 г серной кислоты. Вычислите массу полученной в ходе реакции воды.
29. 40 г оксида меди (II) обработали раствором, содержащим 49 г серной кислоты. Какая масса соли при этом образуется?
30. 5,6 г железа сожгли в 5,6 г хлора (н.у.). Вычислите массу образовавшегося хлорида железа (III).
31. 20 г гидроксида натрия взаимодействует с 32 г сульфата меди (II). Вычислите массу образовавшегося осадка.
32. К раствору, содержащему 26,1 г нитрата бария, добавлен раствор, содержащий 35,5 г сульфата натрия. Какая масса осадка при этом получается?
33. К раствору, содержащему 10,4 г хлорида бария, добавили раствор, содержащий
9,8 г серной кислоты. Определите массу осадка.
34. 14 г оксида кальция обработали раствором, содержащим 36 г азотной кислоты. Какова масса полученной соли?
