Периодическая система и электронная конфигурация
В периодической таблице элементы расположены в порядке возрастания их атомного номера в такой последовательности, что элементы с одинаковыми химическими и физическими свойствами объединены в группы. Поскольку свойства элементов зависят от их атомного номера и электронной структуры, каждая группа элементов имеет подобную электронную конфигурацию.
Запись электронной конфигурации основана на следующих правилах. Порядок заполнения орбиталей - принцип построения (Aufbau Principle):
1. Электроны располагаются на уровнях и подуровнях в порядке возрастания энергии. Электроны сначала заполняют орбитали с низшей энергией - ближе к ядру- затем, уровни и подуровни с более высоким значением энергии. На сравнительной энергетической диаграмме даны относительные значения энергий различных подуровней.
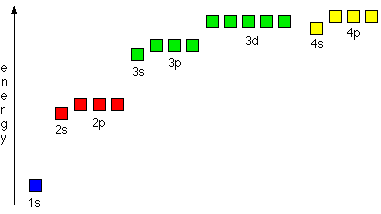
Такое заполнение происходит и в соответствии с Правилом Клечковского: Электроны заполняют уровни и подуровни в порядке возрастания (n+l), и если (n+l) - одинаково, то в порядке возрастания n.
2) Если есть "выбор" между орбиталями равной энергии, электроны заполняют орбитали "по одному" насколько это возможно (это правило называется Правилом Хунда). В случае "p" подуровней возможно три орбитали одинаковой энергии. Такие орбитали называются вырождеными. Также есть 5 и 7 вырожденых орбиталей для d и f подуровней соответственно. В соответствии с прравилом Хунда электроны занимают все такие орбитали, располагаясь там по одному с параллельными спинами. Это происходит потому, что в этом случае минимизируется энергия отталкивания между ними, и это делает атом более стабильным.
3) Электронная конфигурация элемента с любым атомным номером (за исключением атома водорода) может быть получена, если взять электронную конфигурацию предыдущего элемента (с атомным номером равным Z-1) и добавить один электрон на соответствующую орбиталь.
Электронную конфигурацию атома можно записать в виде короткой формулы:
1. цифра, соответствующая главному квантовому числу,
2. буква, обазначающая второе квантовое число, количество электронов на каждой соответствующей орбитали записывается как верхний индекс справа.
Например,
"Электронная" формула элементов 1-го периода:
атом водорода (H)- 1s1; гелия (He) - 1s2
2-го периода: бор (B) 1s22s22px1; кислород (O) 1s22s22px22py12pz1;
у неона весь второй уровень заполнен
3-го периода: магний (Mg) 1s22s22p63s2 (короткая запись) [Ne]3s2;
сера (S) 1s22s22p63s23px23py13pz1 (короткая запись) [Ne]3s23px23py13pz1
4-го периода: 4s уровень K и Ca заполнен, и в структура следующих атомов происходит постепенное заполнение 3d уровня. Таким образом, в зависимости от того какие s, p, d или f орбитали заполняются электронами, элементы периодической системы объединяют в блоки s-блок, p-блок, d-блок и f-блок:
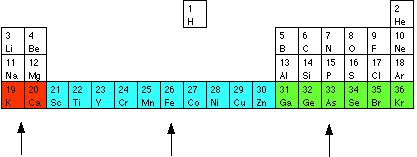
s блок d блок p блок
(заполнение (заполнение (заполнение
4s орбиталей) 3d орбиталей) 4p орбиталей)
У переходных элементов (d блок) с общей конфигурацией электронов (n-1)dnS (n³4) d подуровень не заполнен. Электроны nS уровня могут быть "перетянуты" на (n-1) уровень для заполнения d5 или d10 конфигурации (Cu, Au, Cr 1s22s22p63s23p63d54s1)
Потенциал ионизации (I). Минимальная энергия, необходимая для отделения и перенесения в бесконечность первого, наиболее близкого к ядру электрона, от нейтрального атома в его основном состоянии, называется первым потенциалом ионизации I1. Первый потенциал ионизации относится к процессу M ® M+ + e-. I2 и I3 относятся к процессам удаления 2-го и 3-го электронов соответственно.
Сродство к электрону (E). Сродство атома к электрону можно определить как энергию выделяющуюся при присоединении электрона к нейтральному атому в его основном состоянии, при этом атом становится отрицательно заряженным ионом.
Электроотрицательность (X). Электроотрицательность - это способность атома в молекуле смещать к себе общие электронные пары, т.е. притягивать к себе электроны других атомов.
