Физические свойства алкенов
| Название | Формула | Тпл, ºС | Ткип, ºС | Плотность, г/см3 |
| Этен | СН2=СН2 | -169 | -102,0 | – |
| Пропен | CH2=CH–CH3 | -188 | -48,0 | – |
| 1-Бутен | СН2=СН–СH2–СН3 | -185 | -6,5 | – |
| 1-Пентен | СН2=СН–(СН2)2–СН3 | -185 | 30,0 | 0,643 |
| 1-Гексен | СН2=СН–(СН2)3–СН3 | -138 | 63,5 | 0,675 |
| 1-Гептен | СН2=СH–(СН2)4–СН3 | -119 | 93,0 | 0,698 |
| цис-2-Бутен | 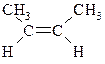 | -139 | 4,0 | – |
| транс-2-Бутен | 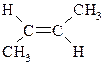 | -106 | 1,0 | – |
| Метилпропен | CH2=C(CH3)2 | -141 | -7,0 | – |
цис-Изомер менее симметричен, чем транс-изомер, поэтому его упаковка в кристаллической решетке менее плотная, что обусловливает, как правило, более низкую температуру плавления цис-изомера.
Алкильная группа подает электроны к углероду с двойной связью. Это объясняется разной гибридизацией атомов углерода. Углерод в состоянии sp2-гибридизации сильнее притягивает электроны, чем углерод в состоянии sp3-гибридизации. Поэтому связь поляризована по схеме:
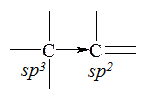
Если дипольный момент связи Csp3– Csp2не компенсируется соответствующим дипольным моментом противоположного направления, то в результате возникает суммарный дипольный момент молекулы.
цис-2-Бутен с двумя метильными группами, расположенными по одну сторону от двойной связи, должен иметь небольшой дипольный момент. В транс-2-бутене с каждой стороны двойной связи находится метильная группа и моменты связей компенсируют друг друга.
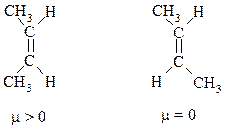
Дипольные моменты полностью симметричных алкенов равны нулю. Несимметричные алкены имеют небольшие дипольные моменты:
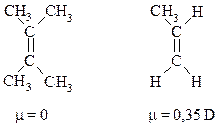
Вследствие незначительно большей полярности температура кипения цис-изомера обычно на несколько градусов выше температуры кипения транс-изомера.
Частота валентных колебаний С=С связи n=1650 см-1, углерод-водородных (Н–С=) связей n=3000 - 3100 см-1. Аналогичная частота n(С–Н) в алканах меньше и составляет приблизительно 2800 см-1. Сравнение частот показывает, что связь =С–Н в алкенах не только более короткая и прочная, но и более жесткая, чем связь С–Н в алканах.
Химические свойства
Атом или группа атомов, которая определяет свойства какого-либо класса органических соединений, называется функциональной группой. В алкенах функциональной группой является двойная углерод-углеродная связь. В алкене более сложном, чем этилен, присутствуют алкильные группы. В определенных условиях алкильные группы в этих молекулах могут вступать в реакции, типичные для алканов. Однако характерными реакциями алкенов являются реакции по двойной углерод-углеродной связи.
Когда имеется сложная молекула с несколькими функциональными группами, то можно ожидать, что свойства этой молекулы будут сочетать свойства различных функциональных групп. Однако свойства отдельной группы будут несколько изменяться под влиянием других групп, и важно понимать эти изменения.
Двойная связь состоит из прочной s-связи и менее прочной p-связи. Типичными реакциями двойной связи являются реакции, в которых происходит разрыв p-связи и образование вместо нее двух более прочных s-связей. Такие реакции называются реакциями присоединения. Они обозначаются символом Аd(Addition - присоединение).
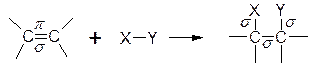
Какие реагенты могут присоединяться к двойной углерод-углеродной связи? Для ответа рассмотрим электронное строение алкенов. Облака p-электронов находятся над и под плоскостью, в которой лежат атомы углерода и водорода. Эти электроны наиболее доступны для реагентов с недостатком электронов. Двойная углерод-углеродная связь служит донором электронов, т.е. ведет себя как основание*. Она реагирует с соединениями, которые обеднены электронами, т.е. с кислотами. Эти реагенты, не имеющие пары электронов, называются электрофильнымиреагентами (электрофил - любящий электроны). Следовательно, типичными реакциями алкенов являются реакции электрофильного присоединения(AdE).
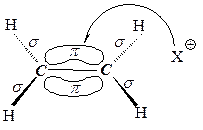
Существуют реагенты другого типа, также обедненные электронами - свободные радикалы. С ними алкены вступают в реакции радикального присоединения(AdR) .
Большинство алкенов содержит алкильные группы, которые являются остатками алканов, следовательно, такие алкены могут подобно алканам участвовать в реакциях свободнорадикального замещенияатома водорода в алкильном остатке(SR).
