В чем сущность действия катализатора?
Механизмы действия катализаторов чрезвычайно многообразны. Решающим является влияние какого-либо вещества на энергию активации реакции, которую следует понимать как энергетический барьер между энергиями исходного и конечного состояний. Понижение энергии возможно, например, вследствие разделения процесса на две последовательно протекающие реакции, энергия активации которых меньше, чем энергия, активации общего процесса.
Механизм действия катализатора, как ускорителя химической реакции, основан на: 1) явлении адсорбции ( поверхностное поглощение) катализатором реагирующих веществ, вследствие чего повышается их концентрация и 2) повышении химической активности адсорбированных молекул благодаря переходу их в возбужденное состояние, в результате чего резко возрастает доля успешных столкновений молекул реагирующих веществ и, соответственно, скорость химической реакции.
50. Электронное состояние атома S в нормальном и возбужденном состояниях. Валентности S. Примеры ее соединения с O2.
В возбужденном состоянии сера помимо валентности, равной двум, проявляет также валентность, равную четырем и шести. При этом последовательно происходит распаривание 3р и 3s-электронов (рис. 5.9).
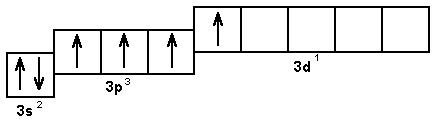
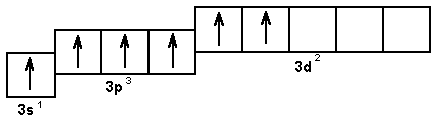
Рис. 5.9. Валентные возможности атома серы в возбужденном состоянии
| Сера / Sulfur | S | -2, +2, +4, +6 |
На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом:
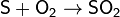
2S + 3O2 –t;pt 2S+6O3
Ковалентная связь. Ее характеристики. Изобразить перекрывание электронных облаков в молекуле HCl.
Ковалентная связь —химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Основных характеристик 5: длина связи, энергия связи, ее пространственная направленность, поляризация и поляризуемость.
Длина связи– расстояние между ядрами атомов, ее образовавшими.
Энергия связи – энергия, необходимая для гомолитического разрыва связи на радикалы или на атомы. Здесь необходимо остановиться на понятиях гомолитического и гетеролитического разрыва связи:
Пространственная направленностьсвязей уже рассмотрена на примере метана, этана, этилена и ацетилена.
Полярность связи и ее поляризуемость.С полярной связью мы уже встречались, рассматривая ковалентный характер связи. При образовании ковалентной связи между двумя одинаковыми атомами ее электронное облако симметрично расположено между ядрами связываемых атомов, связь неполярна, и молекула неполярна (этан, этилен, ацетилен).
