Механизм мышечного сокращения
Рассмотрим, к чему же сводятся представления о механизме попеременного сокращения и расслабления мышц. Установлено, что миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться в его присутствии лишь при наличии в среде определенных концентраций ионов кальция. Наибольшая сократительная активность наблюдается при концентрации ионов кальция около 10~6 — Ю~5 М. При понижении концентрации ионов кальция до 10~7 М или ниже мышечные волокна теряют способность к укорочению и развитию напряжения в присутствии АТФ.
По современным представлениям, в покоящейся мышце (миофибриллах и межфибриллярном пространстве) концентрация ионов кальция поддерживается ниже этой пороговой величины в результате связывания их структурами (трубочками и пузырьками) саркоплазматической сети и так называемой Т-системой при участии особого Са2 +-связывающего белка, получившего название кальсеквестрина, входящего в состав этих структур.
Связывание ионов кальция разветвленной сетью трубочек и цистерн саркоплазматической сети не является простой адсорбцией. Это активный физиологический процесс, который осуществляется за счет энергии, освобождающейся при расщеплении АТФ Са2 +-зависимой АТФазой саркоплазматической сети Ч При этом наблюдается весьма своеобразная картина: скорость выкачивания ионов кальция из межфибриллярного пространства стимулируется ионами кальция. В целом этот механизм получил название «кальциевой п о м п ы» по аналогии с хорошо известным в физиологии «натриевым насосом».
Возможность пребывания живой мышцы в расслабленном состоянии при наличии в ней достаточно высокой концентрации АТФ объясняется снижением в результате действия кальциевой помпы концентрации ионов кальция в среде, окружающей миофибриллы, ниже того предела, при котором еще возможно проявление АТФазной активности и сократимости актомиозиновых структур волокна. Быстрое сокращение мышечного волокна при его раздражении от нерва (или электрическим током) является результатом внезапного изменения проницаемости мембран и как следствие выхода из цистерн и трубочек саркоплазматической сети и Т-системы некоторого количества ионов кальция в саркоплазму.
Как уже отмечалось, «чувствительность» актомиозиновой системы к ионам кальция (т. е. потеря актомиозином способности расщеплять АТФ и сокращаться в присутствии АТФ при снижении концентрации ионов кальция до 10"7 М) обусловлена присутствием в контрактильной системе (на нитях Ф-актина) белка тропонина, связанного с тропомиозином. В тропонин-тропомиозиновом комплексе ионы кальция связываются именно с тропонином. При этом в молекуле тропонина происходят конформационные изменения, которые, по-видимому, приводят к сдвигу всего тропонин-тро-помиозинового стержня и деблокировке активных центров актина, способных взаимодействовать с миозином с образованием сократительного комплекса и активной Мg2+-АТФазы.
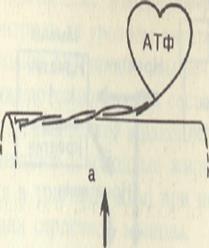
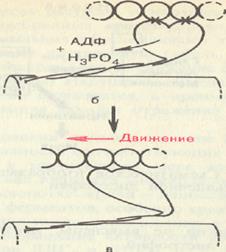
В продвижении актиновых нитей вдоль миозиновых, по данным Э. Хаксли, важную роль играют временно замыкающиеся между нитями поперечные мостики, которые являются «головками» миозиновых молекул.
Kогда мышца находится в состоянии покоя, головки миозина содержат АТФ. После поступления в мышцу нервного импульса по саркоплазматической сети проходит волна возбуждения; ионы Са2 + освобождаются и в это время срабатывает мостиковый механизм, миозиновая головка присоединяется к соответствующему центру активной нити (нити Ф-актина) под углом 90°. Это происходит за счет энергии АТФ. Затем наступает спонтанный поворот головки на 45°, развивается натяжение и происходит продвижение актиновой нити на один элементарный шаг (~ 11 нм).
Далее в результате присоединения новой порции АТФ к поперечному мостику наблюдается диссоциация актомиозина на миозин и актин, т. е. разъединения.
1 Существует еще один компонент Са2 + -регулирующей системы саркоплазматической сети. Это — ионофор, протеолипид, экстрагируемый из сети; известно, что он ускоряет действие АТФазы как насоса.







Миозиновые миофибриллы имеют толщину 10 нм, состоят из пучка продольно ориентированных молекул миозина (около 360)'. В результате электростатического взаимодействия между «хвостами» легкого меромиозина в толстых протофибриллах образуется структура, похожая на многожильный кабель, над поверхностью которого выступают «головки» тяжелого меромиозина. В центральной М-полосе толстых протофибрилл «головки» отсутствуют. Это значит, что миозиновые молекулы соединены здесь своими «хвостами» и «головы» их направлены в разные стороны. Выступающие «головки» расположены по правильным спиральным линиям. На поперечном срезе толстой протофибриллы насчитывается 18 молекул миозина.
 |
Тонкие протофибриллы, имеющие длину около 1000 нм и толщину 6 нм, расположены радиально вокруг толстых протофибрилл (рис. 90) и состоят из двойной спирали фибриллярного актина, в бороздках которой уложены тропомиозиновые молекулы, соединенные с тропонином. Спираль фибриллярного актина включает до 300 мономерных глобул актина, которые являются не только структурными, но и функциональными единицами тонких протофибрилл: каждая из них содержит активный центр, за счет которого возможно образование спаек с миозином. 2-мембраны саркомеров построены из тропомиозина и а-актинина, скрепляющих между собой тонкие протофибриллы.
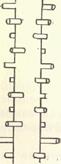 |
| Рис. Схема взаимного расположения толстых и тонких протофибрилл (поперечный срез) |

| Сокращение спайки |
| Расслабление |
Образование спайки
Рис.
Образование и сокращение спайки между актином и миозином
