Равновесия в растворах электролитов
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Раздел « Физическая химия »
МЕТОДИЧЕСКИЕ УКАЗАНИЯ И КОНТРОЛЬНЫЕ ЗАДАНИЯ
(С ПРОГРАММОЙ)
для студентов-заочников
направления 552400 – Технология продуктов питания
Калининград
УДК 541.1(076)
УТВЕРЖДЕНО
Ректором Калининградского
государственного технического университета
2 февраля 1999 г.
АВТОР - Слежкин В.А., канд. хим. наук, доцент кафедры химии Калининградского
государственного технического университета
Шашкова Т.Н., канд. хим. наук, доцент той же кафедры
Методические указания и контрольные задания по физической химии рассмотрены и одобрены на заседании кафедры химии 24 декабря 1997 г., протокол № 4.
РЕЦЕНЗЕНТ –кафедра химии Калининградского государственного технического университета
ã Калининградский государственный технический университет, 1999
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Настоящие методические указания составлены на основе учебной программы по физической и коллоидной химии для подготовки бакалавров по направлению 552400 – Технология продуктов питания, утвержденной проректором Калининградского государственного технического университета 28 ноября 1998 г., и предназначены для выполнения контрольной работы по физической химии.
Изучение каждого раздела рекомендуется проводить, придерживаясь следующего порядка:
1) ознакомиться по программе с содержанием раздела, соответствующего заданию;
2) прочитать в учебнике и в методических указаниях весь относящийся к данному разделу материал, обратив внимание на физическую сущность явления, теоретические положения, математические зависимости и графический материал;
3) повторно прочитать раздел учебника и составить его краткий конспект, в который внести формулировки законов, основные уравнения и их выводы, графики и схемы; при составлении конспекта стремиться к четкому и ясному изложению материала своими словами, избегая механической переписки текста;
4) ответить на вопросы контрольного задания и решить задачи, используя примеры, приведенные в разделе решения типовых задач.
Решать задачи необходимо в той последовательности, в какой они даны в методических указаниях.
Графики, которые необходимо выполнить по условиям задач, вычерчиваются на миллиметровой бумаге с соблюдением следующих правил:
1) размер графика должен быть не менее половины листа тетради;
2) на осях координат отмечаются через равные интервалы масштабные единицы;
3) масштаб выбирается таким образом, чтобы кривая занимала по возможности все поле чертежа;
4) точки должны четко наноситься на график в соответствии с выбранным
масштабом (без нанесения дополнительных линий их координат);
5) точки соединяются плавной кривой таким образом, чтобы большинство из них
попало на кривую или были в одинаковой мере отдалены по обе стороны от кривой;
6) при нахождении производной графическим способом следует брать отношение фактических размеров отрезков, отсекаемых касательной на осях координат.
Выбор варианта каждого номера задачи (табл. 18) проводится по двум последним цифрам шифра студенческого билета и зачетной книжки. Например, если последние две цифры шифра 8 и 1, то решайте задачи и отвечайте на вопросы 81 варианта.
Условия задач и текст вопросов приводятся обязательно.
В конце работы должен быть приведен список литературы.
Работа подписывается студентом с проставлением даты ее окончания.
Программа, методические указания и вопросы для самопроверки
Введение
Физическая химия, ее связь со смежными науками. Методы физической химии, их использование в технологии пищевых продуктов.
Элементы учения о строении вещества
Строение молекул и природа химической связи. Молекулярные спектры, их классификация. Спектроскопия. Экспериментальные методы определения строения молекул. Межмолекулярное взаимодействие и агрегатное состояние вещества.
Методические указания
Существует ряд методов для определения молекулярных констант, из которых в данной программе рассматриваются только электронно-колебательно-вращательные спектры.
Каждому электронному, колебательному и вращательному состоянию молекулы можно приписывать определенный энергетический уровень. Взаимное расположение таких уровней и переходы между ними определяют характер спектра. Спектроскопические методы исследования позволяют определять моменты инерции вращения, межатомные расстояния, энергию колебательного движения, энергию диссоциации и другие составляющие, на основании которых вычисляются термодинамические свойства вещества, кинетические характеристики процесса и многое другое.
2. Основы химической термодинамики
Первое начало термодинамики. Внутренняя энергия, теплота и работа. Функции состояния и функции процесса. Энтальпия. Закон Гесса. Вычисление тепловых эффектов химических процессов. Калориметрия. Определение калорийности пищевых продуктов. Зависимость теплового эффекта от температуры. Закон Кирхгофа.
Второе начало термодинамики. Термодинамически обратимые и необратимые процессы. Работа обратимого процесса. Равновесие как наиболее вероятное состояние системы. Энтропия. Аналитическое выражение второго начала термодинамики для обратимых и необратимых процессов. Энтропия как мера вероятности. Термодинамические расчеты изменения энтропии в различных процессах. Термодинамические свойства газов и их смесей.
Термодинамическая теория химического сродства. Термодинамические функции. Второе начало термодинамики в открытых системах и живые организмы. Элементы термодинамики необратимых процессов.
Третий закон термодинамики, абсолютная энтропия.
Методические указания
Термодинамический метод является одним из самых мощных методов физической химии. Он дает точные соотношения между энергией и свойствами системы,нетребуя каких-либо сведений о строении молекул или механизме процессов. Термодинамика применяется к системам, находящимся в равновесии, и рассматривает только начальные и конечные состояния.Она не описывает протекания процессов во времени, она только отвечает на вопрос, насколько глубоко должна пройти данная реакция, прежде чем будет достигнуто равновесие.
Приступая к изучению законов химической термодинамики, усвойте основные понятия и определения, которыми она пользуется. К таким понятиям относятся термодинамическая, открытая и закрытая, изолированная, гомогенная, одно- и многокомпонетная системы. Интенсивные свойства системы, которые количественно независимы от объема и массы системы, принято называть термодинамическими параметрами состояния.
Когда система под влиянием различных воздействий переходит от начального равновесного состояния к конечному, изменение любого ее свойства не зависит от пути процесса. Бесконечно малое изменение любого свойства — это полный дифференциал, интеграл от которого не зависит от пути итегрирования.Так как теплота и работа являются формами передачи энергии между внешней средой и системой и относятся к определенному процессу, они не могут быть функциями состояния системы. Бесконечно малое количество теплоты и работы обозначают 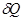 и
и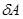 .
.
Для бесконечно малого изменения состояния системы математическое выражение первого закона термодинамики примет вид 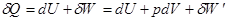 , где
, где 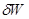 —сумма всех элементарных работ, равная работе преодоления внешнего давления pdV и прочих сил
—сумма всех элементарных работ, равная работе преодоления внешнего давления pdV и прочих сил 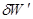 (так называемая полезная работа).
(так называемая полезная работа).
Теплота, получаемая системой, считается положительной, а отдаваемая—отрицательной. Необходимо усвоить разницупонятий «теплота процесса» и «тепловой эффект процесса».
Теплота процесса—это количество теплоты, выделенной или поглощенной в любом процессе.
Тепловой эффект процесса — это количество теплоты, которая поглощается или выделяется в процессе, протекаемом термодинамически необратимо при постоянном объеме или давлении, если к тому же температура исходных веществ и продуктов реакции одинаковая и W'=0.
Для понимания всех термодинамических расчетов, с которыми на протяжении курса придется встречаться, следует знать, какие процессы называют обратимыми и какие—необратимыми. Во всяком обратимом процессе равновесная система проходит через последовательный ряд равновесных состояний. Поэтому в таком процессе осуществляется максимальная работа, если она производится системой над внешней средой, и минимальная — в обратном случае.Отсюда вытекают характерные особенности обратимого процесса: его двусторонность, отличие внешних сил от внутренних на бесконечно малую величину, малое различие температуры равновесной системы и внешней среды при протекании неизотермического процесса, бесконечно медленное протекание процесса, отсутствие расхода энергии на разные потери.
Каким бы путем система ни вернулась в исходное состояние, ее свойства останутся неизменными, и только в обратимом процессе допускается возможность возвращения системы в первоначальное состояние без каких-либо изменений не только в самой системе, но и во внешней среде.
Чтобы понять, что происходит в системе при изменении температуры и давления, необходимо знать, что внутренняя энергия системы складываетсяиз кинетической энергии молекулярного движения, из энергии взаимного притяжения и отталкивания частиц, составляющих систему, из химической внутримолекулярной энергии, энергии электронного возбуждения, внутриядерной энергии, лучистой энергии н гравитационной энергии, обусловленной тяготением частиц друг к другу.
В отличие от первого закона термодинамики второй закон применим к явлениям, представляющим собой результат действия большого числа частиц, т. е. к явлениям, к которым применимы законы вероятности. Статистическая природа второго закона позволяет определять наиболее вероятный путь процесса. Наряду с другими формулировками второго закона термодинамики, которые подчас носят частный характер, обращаем внимание на формулировку, согласно которой за счет любого самопроизвольного процесса можно получить работу. Если при этом процесс будет протекать термодинамически обратимо, то работа будет максимальной, определяющей движущую силу процесса.
Исходя из основного уравнения второго начала термодинамики 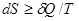 , надо уметь показать, что: 1) только в изолированной системе энтропия как функция состояния определяет направленность процессов и состояние равновесия независимо от характера процесса; 2) в неизолированных системах при соответствующих условиях направленность процессов, их состояние равновесия н движущая сила процесса (
, надо уметь показать, что: 1) только в изолированной системе энтропия как функция состояния определяет направленность процессов и состояние равновесия независимо от характера процесса; 2) в неизолированных системах при соответствующих условиях направленность процессов, их состояние равновесия н движущая сила процесса ( 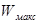 ) определяются с помощью термодинамических потенциалов: А—энергия Гельмгольца (изохорно-изотермический потенциал при V, T—const), G—энергия Гиббса (изобарно-изотермический потенциал при р и Т—const), U—внутренняя энергия {изохорно-изоэнтропийный потенциал, V и S—const), H—энтальпия (изобарно-изоэнтропийный потенциал, р и S—const).
) определяются с помощью термодинамических потенциалов: А—энергия Гельмгольца (изохорно-изотермический потенциал при V, T—const), G—энергия Гиббса (изобарно-изотермический потенциал при р и Т—const), U—внутренняя энергия {изохорно-изоэнтропийный потенциал, V и S—const), H—энтальпия (изобарно-изоэнтропийный потенциал, р и S—const).
Все термодинамические потенциалы являются свойствами системы при любых условиях, но направленность процессов они определяют только при постоянстве соответсвующих двух параметров.
Для практических расчетов пользуются абсолютными значениями энтропии в стандартном состоянии, вычисленными при помощи постулата Планка (энтропия чистых твердых веществ, образующих идеальные кристаллы, при абсолютном нуле равна нулю) и сведенными в таблицы. В справочниках, как правило, энтропия дается при 298 К и обозначается 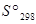 . Стандартным состоянием вещества называют состояние, в котором это вещество находится под давленном 1,0133
. Стандартным состоянием вещества называют состояние, в котором это вещество находится под давленном 1,0133 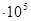 Па. От этих значений энтропии легко перейти к абсолютным значениям при любой температуре. Стандартное значение энтропии при температуре Т обозначается
Па. От этих значений энтропии легко перейти к абсолютным значениям при любой температуре. Стандартное значение энтропии при температуре Т обозначается 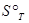 . Другие термодинамические функции приводят в виде изменения
. Другие термодинамические функции приводят в виде изменения 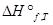 ,
, 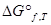 и т.д. f указывает, что это функция образования.
и т.д. f указывает, что это функция образования.
В курсе физической химии приходится часто встречаться с понятием «химический потенциал», введенным в термодинамику Гиббсом. Химический потенциал какого-либо компонента в смеси равен частной производной термодинамического потенциала системы по количеству молей данного вещества:
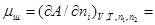
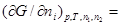
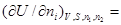
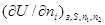 .
. 
В каждом отдельном случаечастная производная берется при постоянстве тех параметров, при которых термодинамический потенциал определяет направленность процесса, а также при постоянстве числа молей в системе всех веществ, кроме того вещества, для которого определяется химический потенциал. Таким образом, химический потенциал показывает, насколько изменится термодинамический потенциал системы при соответствующих условиях, если в бесконечно больший объем ее прибавить 1 моль данного вещества.
Подобно тому как температура является движущей силой при теплопередаче, химический потенциал—движущая сила, определяющая переход массы. Отсюда следует, что если данный компонент присутствует в равновесной системе в нескольких сосуществующих фазах, то значение его химического потенциала будет одинаковым в каждой фазе.
Вопросы для самопроверки
1. Дайте определение понятия «система».Система закрытая и открытая. Изолированная система. Гомогенная и гетерогенная системы.
2. Дайте определение понятиям «теплота» и «работа».
3. Дайте определение функции состояния. Покажите, что любой параметр состояния можно рассматривать как функцию состояния, а теплота и работанеявляются функциями состояния.
4. Какие формулировки первого закона термодинамики вам известны?
5. Напишите уравнение первого закона термодинамики и укажите, какие величины, входящие в это уравнение, зависят от пути процесса.
6. Каково соотношение между 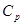 и
и 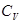 для идеального газа?
для идеального газа?
7. Какиевы знаете интерполяционные уравнения, выражающие зависимость теплоемкости от температуры?
8. Что называется тепловым эффектом химической реакции?
9. Что называется теплотой образования и сгорания?
10. В чем отличие обратимых и необратимых процессов?
11. В каком случае изменение энтропииявляется критерием самопроизвольности процесса?
12. Каков физический смысл термодинамических и химических потенциалов? Могутли они быть отрицательными? Вчем заключается различие между химическим и термодинамическим потенциалами?
13. В каких условиях термодинамические функции приобретают свойства потенциалов? Какие термодинамические потенциалы вы знаете?
14. Какие функции состояния определяют направленность процесса в неизолированной системе, если процесс протекает при постоянных V и Т или р и Т?
15. При каких условиях внутренняя энергия системы может служить критерием направленности процесса?
16. Что такое термодинамическое равновесие?
17. Как определить изменение энтропии в процессе фазового превращения (испарения, плавления, возгонки)?
18. К какому значению стремится энтропия правильно образованного кристалла при приближении температуры к абсолютномунулю?
3. Химическое равновесие
Химический потенциал и общие условия равновесия систем. Влияние внешних условий на состояние равновесия. Константа равновесия, термодинамический вывод. Связь константы равновесия с максимальной работой реакции. Химическое сродство. Зависимость константы равновесия от температуры, изобара и изохора химической реакции. Химическое равновесие в гетерогенных системах. Расчет химического равновесия.
Методические указания
Учение о химическом равновесии является одним из основных разделов курса физической химии. В нем на основе первого и второго законов термодинамики, имеющих общий характер, а также тепловой теоремы Нернста и постулата Планка, называемых третьим законом термодинамики, решаются вопросы, связанные с расчетом химического равновесия, устойчивости веществ и направленности процесса, выяснением оптимальных условий режима в процессе химического превращения, позволяющих добиться максимального выхода желаемых веществ.
Необходимо знать, как можно, не прибегая к исследованию химического превращения, связанного с затратой больших средств, на основании термических и термохимических данных для исходных веществ и продуктов реакции теоретически предсказать возможность осуществления данного процесса и произвести расчеты выходов при различных условиях его протекания.
Вот почему усвоить этот раздел—значит не только осмысленно выводить уравнения изотермы, изохоры, изобарыхимической реакции, понять сущность третьего закона термодинамики, но и уметь производить расчеты констант химического равновесия, выраженных различным образом, расчеты выходов продуктов реакций при различных условиях опыта, тепловых эффектов реакции на основании экспериментальных данных по изучению равновесного состояния реакции. Только при этих условиях можно научиться решать кардинальные вопросы синтеза новых веществ и интенсификации существующих производств.
Вопросы для самопроверки
1. Условия равновесия с позиций кинетики и термодинамики. В чем сходство и различие подхода к условиям равновесия с позиций кинетики и термодинамики?
2. Дайте определение понятия химического равновесия. Динамический характер химического равновесия.
3. Может ли постоянство концентраций реагирующих веществ свидетельствовать о химическом равновесии?
4. Через какие величиныможно выразить константу химического равновесия? Связь между константами равновесия, выраженными различными способами.
5. Как, исходя из принципа Ле Шателье, предвидеть влияние температуры на | константу равновесия?
6. Как определить, в каком направлении пойдет реакция в данных условиях? Что является критерием направленности процесса химического превращения? Каково условие достижения равновесного состояния?
7. Что называется максимальной и максимально полезной работой химической реакции? При каких условиях она могла бы быть полезной?
8. От чего зависит химическое сродство? Что называется стандартным химическим сродством?
9. Как рассчитать температуру, при которой произойдет изменение направления реакции?
10. Выведите уравнение зависимости константы равновесия от температуры.
11. Как производится приближенное и уточненное интегрирование уравнения изобарыхимической реакции?
4. Фазовые равновесия и растворы
Термодинамика фазовых переходов. Условия равновесия фаз в гетерогенных системах. Правило фаз Гиббса. Уравнение Клаузиуса-Клапейрона. Однокомпонентные системы. Диаграммы состояния однокомпонентных систем.
Двухкомпонентные системы. Растворы. Общая характеристика.
Состав и давление насыщенного пара растворов. Температура кипения и кристаллизации растворов. Законы Рауля. Криоскопия и эбуллиоскопия. Охлаждающие льдосоляные смеси. Диффузия и осмос. Законы осмотического давления. Гипо-, изо- и гипертонические растворы.
Значение осмотического давления для биологических и технологических процессов. Обратный осмос.
Взаимная растворимость жидкостей. Идеальные растворы. Реальные растворы, положительные и отрицательные отклонения от закона Рауля. Диаграммы состояния. Законы Коновалова. Дистилляция двойных смесей. Правило рычага. Азеотропные смеси и их разделение. Азеотропные смеси в технологии пищевых и кормовых продуктов. Давление пара систем из взаимно нерастворимых жидкостей. Перегонка с водяным паром. Равновесие в трехкомпонентных растворах. Закон распределения Нернста-Шилова. Экстракция, факторы, влияющие на степень экстракции. Процессы экстракции в технологии, контроле качества пищевой продукции.
Методические указания
Ознакомившись с сущностью физико-химического анализа, его значением, освоившись с понятиями «фаза», «компонент», «степени свободы», обратите внимание на следующее.
Фаза не является понятием, адекватным понятию агрегатного состояния. В однокомпонентных системах могут находиться в равновесном состоянии две фазы одинакового агрегатного состояния серы, например, моноклинная, ромбическая.
В тех случаях, когда число компонентов в системе меньше числа веществ, выбор веществ в качестве компонентов произволен. Когда же в равновесной системе имеются две фазы с тождественным составом, то независимо от числа веществ система будет вести себя как однокомпонентная. Так, азеотропная смесь, состоящаяиз любого числа веществ,— система однокомпонентная, так как состав пара и жидкости одинаковый. Такой вывод является следствием из правила фаз Гиббса, а не эмпирическим правилом.
Число степеней свободы определяется числом компонентов и фаз, находящихся в равновесной системе. Оно может быть равным нулю, единице, двум, трем и т. д. Необходимо в каждом отдельном случае уметь сделать практические выводы в зависимости от числа степеней свободы, помня, что выбор параметра в качестве степени свободы произволен. Следует пользоваться правилом фаз при изучении однокомпонентных (диаграммы состояния воды, серы), двухкомпонентных и простейших трехкомпонентных систем (жидкие смеси, сплавы и растворы твердых веществ в жидких растворителях).
На изучении опытных данных диаграмм состав—давление, состав—температура кипения бинарных безгранично смешивающихся жидких смесей основаны два закона Коновалова и три закона Вревского, а на изучении двух- и трехкомпонентных систем — правило рычага.
Изучая перегонку смесей, уясните, что различные виды перегонки (перегонка в равновесии, простая перегонка и ректификация) основаны на различии состава пара и жидкости.
Во всех уравнениях, выражающих связь между концентрацией идеального раствора и каждым его свойством, значение свойства не зависит от природы растворителя (осмотическое давление, относительное понижение давления пара) или не зависит от природы растворенного вещества (изменение температур замерзания и кипения растворов), а определяется только числом частиц растворенного вещества. Это обстоятельство послужило основанием для физической теории растворов и позволило понять свойства разбавленных растворов электролитов, в уравнения расчета которых вводится коэффициент Вант-Гоффа, учитывающий увеличение числа частиц вследствие диссоциации.
Необходимо освоить химическую теорию растворов, в развитии которой большая роль принадлежит Д. И. Менделееву. На положениях этой теории основаны современные представления о процессах растворения, при этом всегда учитывается влияние полярности молекул растворителя на растворимость данного вещества.
Вопросы для самопроверки
1. Что называется фазой, компонентом и степенью свободы?
2. Как определяется число компонентов системы?
3. Что показывает число степеней свободы?
4. Сколько фаз и степеней свободы на плоскости, на линиях и в тройных точках на диаграмме состояния воды? При каких условиях система имеет минимум степеней свободы и чему он равен?
5. Как определить при заданной температуре теплоту испарения, если зависимость давления насыщенного пара от температуры p=f(T)?
6. Выведите уравнение Клапейрона—Клаузиуса с учетом зависимости теплоты испарения от температуры и проинтегрируйтеего.
7. От чего зависит изотонический коэффициент Вант-Гоффа?
8. Как зависит давление насыщенного пара раствора от концентрации нелетучего растворенного вещества при данной температуре?
9. Как зависит растворимость газов от давления, каким законом эта зависимость выражается? При каких условиях растворимость газов подчиняется закону Генри?
10. Как зависит растворимость газов от температуры и концентрации твердого растворенного вещества?
11. Какой жидкий раствор называют идеальным, каковы его основные признаки и при каких условиях он образуется?
12. Чем обусловливаются положительные и отрицательные отклонения от закона Рауля? Приведите примеры различных типов бинарных жидких неограниченно смешивающихся растворов.
13. В чем заключаются первый и второй законы Коновалова? Поясните эти законы на диаграммах: состав—температура кипения и состав—давление.
14. В чем заключаются перегонка в равновесии, простая перегонка и ректификация? Поясните различные виды перегонок на диаграмме состав — температура кипения.
15. Назовите типы бинарных жидких растворов с ограниченной растворимостью. Приведите примеры.
16. На чем основана перегонка с водяным паром, когда ее применяют и как определяется расход водяного пара на каждый килограмм отгоняемого вещества?
17. В чем заключается правило прямолинейного диаметра Алексеева?
18. На чем основан термический анализ?
19. В чем различие понятий: «эвтектическая точка», «эвтектическая температура» и «эвтектика»?
20. Как изображается состав трехкомпонентной системы по методу Гиббса и по методу Розебума?
21. В чем заключается закон распределения Нернста—Шилова?
22. В чем заключается процесс экстрагирования, какова его теоретическая основа?
Равновесия в растворах электролитов
Растворы электролитов. Теория электролитической диссоциации. Электропроводность растворов электролитов. Удельная и эквивалентная электропроводность. Зависимость от концентрации. Предельная эквивалентная электропроводность. Подвижность ионов. Числа переноса. Закон независимого движения ионов. Практическое использование электропроводности. Применение солемеров для анализа технологических растворов. Электропроводность, ее использование для оценки качества сырья и продуктов.
Электродные потенциалы, их возникновение. Гальванические элементы. Электродвижущие силы гальванических элементов. Термодинамика гальванического элемента. Уравнение Нернста. Стандартные электродные потенциалы. Классификация электродов и их характеристика. Электроды сравнения и индикаторные электроды.
Гальванические элементы различных типов, их характеристика. Компенсационный метод измерения э.д.с. Применение потенциометрических измерений для расчета различных величин в анализе. рН-метры в технологии и контроле производства пищевой продукции. Биоэлектрические потенциалы.
Основные понятия кинетики электродных процессов. Электролиз. Химическая и концентрационная поляризация электродов, перенапряжение. Некоторые прикладные аспекты кинетики электродных процессов. Химические источники тока. Электрохимическая коррозия металлов, методы защиты от коррозии. Использование защитных металлических и неметаллических покрытий в пищевой промышленности. Эффективность защиты железа оловом. Применение электролиза для лужения жести и регенерации олова из ее отходов.
Методические указания
Электрохимия занимается изучением закономерностей, связанных с взаимным превращением химической и электрохимической форм энергии. Химические реакции сопровождаются обычно поглощением или выделением теплоты — тепловым эффектом реакции, а не электрической энергии.
В электрохимии рассматриваются реакции или протекающие за счет подведенной извне электрохимической энергии, или служащие источником ее получения. Такие реакции называются электрохимическими. Очевидно, что электрохимические реакции с термодинамической точки зрения не идентичныхимическим,поэтому электрохимия должна рассматриваться как самостоятельный раздел физической химии, выделившийся в самостоятельную науку.
Изучая удельную и эквивалентную электрические проводимости, влияние различных факторов на их значение, уясните, что величину удельной и эквивалентной электрической проводимости различных электролитов определяют валентность ионов, их абсолютная скорость и число ионов в единице объема (в случае удельной электрической проводимости) и в объеме, содержащем килограмм-эквивалент массы (в случае эквивалентной электрической проводимости). Тогда станет понятным влияние на удельную и эквивалентную электрическую проводимости размера иона (кристаллографического радиуса), степени сольватации, природы растворителя, температуры, концентрации электролита и неэлектролита, вязкости раствора и особенно в случае сильных электролитов наличия электростатического взаимодействия между ионами, приводящего к образованию ионных атмосфер.
Переходя к изучению свойств сильных электролитов, необходимо знать, какие экспериментальные данные явились основанием для появления теории сильных электролитов. Рассматривая основные положения электростатистической теории сильных электролитов по Дебаю и Гюккелю, обратите внимание на неточности, допущенные при расчете коэффициента активности соли и ионов, которые привели к тому, что полученные уравнения для расчета коэффициента активности применимы только к разбавленным растворам.
При изучении гальванических элементов обратите внимание на то, что скачок потенциала всегда возникает при соприкосновении двух проводников одного и того же или разного рода. Выясните, какие факторы определяют значение потенциалов. Уясните разницу между понятиями «потенциал на границе металл— раствор» и «электродный потенциал». Необходимо ознакомиться с принятой классификацией электродов (первого, второго рода и редокс-электроды) и различными типами гальванических элементов.
В концентрационных элементах ток возникает за счет выравнивания концентрации ионов или вещества электрода, а в химических элементах — за счет химической реакции.
Вопросы для самопроверки
1. Что называется удельной электрической проводимостью?
2. Что называется эквивалентной электрической проводимостью?
3. Как зависит эквивалентная электрическая проводимость слабых электролитов от концентрации?
4. Какова связь между подвижностью ионов и их абсолютной скоростью?
5. По каким признакам тот или иной электролит относится к сильным или слабым? Какому закону подчиняются слабые электролиты и в чем его смысл?
6. Почему подвижность ионов Н+ и ОН- резко отличается от подвижности остальных ионов?
7. Какие процессы, происходящие на границе металл — раствор, приводят к появлению двойного электрического слоя?
8. Что представляют собой электроды I и II рода? Приведите примеры.
9. Приведите примеры различных концентрационных элементов.
10. Какие количественные законы электролизавам известны? Что называется электрохимическим эквивалентом, выходом по току?
11. Что такое ряд напряжений? Значения каких электродных потенциалов указаны в нем?
12. К какому типу электродов относится платино-хингидронный электрод? В каких растворах можно пользоватьсяим для измерения рН раствора?
