Опыт 4. Качественное определение активности различных катализаторов на примере разложения пероксида водорода
Пероксид водорода разлагается при комнатной температуре в присутствии различных катализаторов по уравнению
2 H2O2 → 2 H2O + O2.
Изучить действие двух катализаторов на скорость разложения пероксида водорода: оксида свинца (IV) и оксида марганца (IV).
В две пробирки внести по 10 капель 30 %-ного раствора пероксида водорода. В одну пробирку добавить немного (на кончике шпателя) оксида свинца (IV), а в другую – столько же оксида марганца (IV). О скорости разложения пероксида водорода судят по интенсивности выделения пузырьков газа. Как доказать, что в обеих пробирках выделяется кислород? Какой из использованных катализаторов эффективней?
Опыт 5. Гетерогенный катализ. Изучение влияния количества катализатора на скорость разложения пероксида водорода
В две пробирки с помощью мерного цилиндра налить по 5 мл 3 %-го раствора пероксида водорода. В первую пробирку добавить на кончике шпателя порошка оксида марганца (IV), во вторую - в два раза больше. Записать время начала и окончания выделения пузырьков кислорода в обеих пробирках. Сделать вывод о влиянии количества катализатора оксида марганца (IV) на скорость разложения пероксида водорода.
Опыт 6. Автокатализ
Изучить явление автокатализа на примере взаимодействия перманганата калия со щавелевой кислотой, протекающей по уравнению:
5 H2C2O4 + 2 KMnO4 + 3 H2SO4 = 10 CO2 + 2 MnSO4 + K2SO4 + 8 H2O.
В пробирку внести одну каплю раствора перманганата калия. Добавить к раствору дистиллированной воды в таком количестве, чтобы получился прозрачный розовый раствор. В сухую пробирку налить 10 капель полученного розового раствора и добавить 2 капли щавелевой кислоты и 4 капли раствора серной кислоты. Смесь перемешать, встряхнув пробирку. Тут же включить секундомер. Отметить время обесцвечивания раствора.
Повторить опыт в другой пробирке, предварительно добавив к смеси растворов один кристаллик сульфата марганца (II).
Объяснить, почему во втором случае реакция протекает быстро, а в первом она постепенно ускоряется.
Химическое равновесие
Все химические реакции можно разделить на две группы: необратимые и обратимые. Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ, т.е. протекают только в одном направлении. Обратимые реакции протекают не до конца. При обратимой реакции ни одно из реагирующих веществ не расходуется до конца. Обратимая реакция может протекать как в прямом, так и в обратном направлении.
Пример необратимой реакции:
Zn + 4 HNO3 → Zn(NO3)2 + 2 NO2 + 2 H2O.
Пример обратимой реакции:
H2 + J2 ⇄ 2 HJ.
В начале процесса прямая реакция идет с большой скоростью:
V1 = K1[H2][J2].
Постепенно концентрация исходных реагентов уменьшается и уменьшается скорость прямой реакции.
По мере накопления йодоводорода всё с большей скоростью начинает протекать обратный процесс разложения йодоводорода.
V2 = K2[HJ]2.
Через некоторое время скорости прямой и обратной реакции становятся равными:
V1 = V2; K1[H2]∙[J2] = K2[HJ]2
или
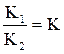
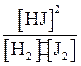 ,
,
где К – константа равновесия.
Химическое равновесие – это такое состояние системы, при котором скорости прямой и обратной реакций равны.
Для обратимой реакции
mA + nB ⇄ pC + qD,
константа химического равновесия равна
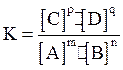 .
.
В обратимых химических реакциях равновесие устанавливается в тот момент, когда отношение произведения концентраций продуктов, возведенных в степени, равные стехиометрическим коэффициентам, к произведению концентраций исходных веществ, также возведенных в соответствующие степени, равно некоторой постоянной величине, называемой константой химического равновесия.
Константа химического равновесия зависит от природы реагирующих веществ и от температуры. Концентрации, при которых устанавливается равновесие, называются равновесными. Изменение внешних условий (концентрации, температуры, давления) вызывает смещение химического равновесия в системе и переход ее в новое равновесное состояние.
Подобный переход реакционной системы из одного состояния к другому называется смещением (или сдвигом) химического равновесия.
Направление смещения химического равновесия определяется принципом Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, производить какое-либо внешнее воздействие (изменять концентрацию, температуру, давление), то в этой системе самопроизвольно возникают процессы, стремящиеся ослабить произведенное воздействие.
Повышение концентрации одного из исходных реагентов сдвигает равновесие вправо (усиливается прямая реакция); повышение концентрации продуктов реакция смещает равновесие влево (усиливается обратная реакция).
Если реакция протекает с увеличением числа молекул газа (т.е. в правой части уравнения реакции суммарное число молекул газов больше, чем число молекул газообразных веществ в левой части), то повышение давления препятствует реакции, а уменьшение давления – благоприятствует реакции.
При повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении – в направлении экзотермической реакции.
Катализатор изменяет в одинаковое число раз как скорость прямой, так и обратной реакции. Поэтому катализатор не вызывает сдвиг равновесия, а лишь сокращает или увеличивает время, необходимое для достижения равновесия.
Лабораторная работа: Химическое равновесие
Цель работы: Изучение влияния различных факторов на установление и смещение химического равновесия.
Оборудование и реактивы: Спиртовка. Пробирки. Хлорид калия (крист.). Хлорид аммония (крист.). Растворы: хлорида железа (III) (насыщ.), роданида калия (насыщ.), хромата калия (1 М), серной кислоты (1 М), гидроксида калия (2 М).
Опыт 1. Влияние концентрации реагирующих веществ на хими-ческое равновесие
Классическим примером обратимой реакции является взаимодействие между хлоридом железа и роданидом калия:
FeCl3 + 3 KCNS ⇄ Fe(CNS)3 + 3 KCl.
Образующийся роданид железа имеет красный цвет, интенсивность которого зависит от концентрации. По изменению окраски раствора можно судить о смещении химического равновесия в зависимости от увеличения или уменьшения содержания роданида железа в реакционной смеси. Составить уравнение константы равновесия данного процесса.
В мерный стаканчик или цилиндр налить 20 мл дистиллированной воды и добавить одну каплю насыщенного раствора хлорида железа (III) и одну каплю насыщенного раствора роданида калия. Полученный окрашенный раствор разлить в четыре пробирки поровну. Пробирки пронумеровать.
В первую пробирку прибавить одну каплю насыщенного раствора хлорида железа (III). Что наблюдается? Дать объяснение, исходя из уравнения константы равновесия.
Во вторую пробирку прибавить одну каплю насыщенного раствора роданида калия. Чем объясняется, что изменение концентрации роданида калия вызывает более эффективное смещение равновесия, чем изменение концентрации хлорида железа (III)?
В третью пробирку добавить кристаллический хлорид калия и сильно взболтать.
Четвёртая пробирка - для сравнения.
Исходя из принципа Ле Шателье, объяснить, чем вызвано изменение окраски в каждом отдельном случае.
Результаты опыта записать в таблицу.
| № пробирки | Что добавлено | Изменение интенсивности окраски | Направление смещения равновесия (вправо, влево) |
Опыт 2. Влияние среды на смещение химического равновесия
Соли хромовой кислоты - хроматы – окрашены в желтый цвет, а соли дихромовой кислоты – дихроматы – в оранжевый цвет. В растворах этих солей имеет место равновесие, которое легко смещается при изменении концентрации ионов водорода:
2 CrO42- + 2 H+ ⇄ Cr2O72- + H2O.
Хромат-ион дихромат-ион
(желтый) (оранжевый)
В пробирку внести 5-6 капель раствора дихромата калия и прибавить столько же капель раствора гидроксида калия. Наблюдать переход окраски.
Затем к этому же раствору по каплям прибавлять раствор серной кислоты до тех пор, пока окраска раствора не станет прежней. Объяснить, исходя из принципа Ле Шателье, изменение окраски раствора.
Опыт 3. Влияние температуры на смещение химического равновесия
Хлорид аммония образуется по уравнению реакции
NH3 + HCl ⇄ NH4Cl, ΔН < 0.
В пробирку с газоотводной трубкой внести один шпатель хлорида аммония. Пробирку осторожно нагреть. Объяснить исчезновение хлорида аммония на дне пробирки и появление белого осадка на холодных стенках пробирки и газоотводной трубки.
