Теория метода валентных связей
Метод разработан В. Гейтлером и Дж. Лондоном. Большой вклад в его развитие внесли также Дж. Слейтер и Л. Полинг.
Основные положения метода валентных связей:
1. Химическая связь образуется двумя валентными электронами различных атомов с антипараллельными спинами. При этом происходит перекрывание электронных облаков и между атомами возникает зона с повышенной электронной плотностью. Это приводит к уменьшению потенциальной энергии системы.
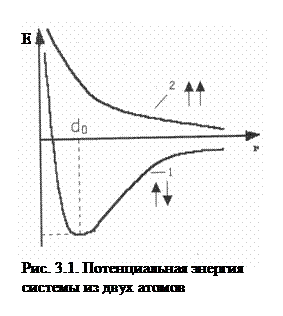 Основатели метода валентных связей Гейтлер и Лондон (1927г.) рассчитали потенциальную энергию системы, состоящей из двух атомов водорода (два протона и два электрона). Для расчета энергетического состояния электронов в молекуле водорода было использовано уравнение Шредингера для двух вариантов: а) спины электронов сближающихся атомов антипараллельны, ↑↓; б) спины электронов сближающихся атомов параллельны, ↑↑ (рис. 3.1).
Основатели метода валентных связей Гейтлер и Лондон (1927г.) рассчитали потенциальную энергию системы, состоящей из двух атомов водорода (два протона и два электрона). Для расчета энергетического состояния электронов в молекуле водорода было использовано уравнение Шредингера для двух вариантов: а) спины электронов сближающихся атомов антипараллельны, ↑↓; б) спины электронов сближающихся атомов параллельны, ↑↑ (рис. 3.1).
Проведенный расчет показал, что:
а) при сближении двух атомов водорода с антипараллельными спинами (кривая 1) на расстояние d0 система имеет минимальную энергию; cледовательно, в этом случае образуется устойчивая химическая связь с энергией Есв. и длиной связи ℓ: ℓ = 0,074 нм < 2а0 = 0,106 нм (а0 – радиус атома водорода);
б) если спины электронов паралельны (↑↑), энергия системы при любом расстоянии между сближающимися атомами больше, чем сумма энергий двух отдельных атомов (кривая 2) и образование химической связи невозможно.
2. В пространстве связь располагается по направлению, в котором возможность перекрывания электронных облаков наибольшая. Из нескольких связей, образуемых данным атомом, наиболее прочной будет та связь, у которой перекрывание атомных орбиталей наибольшее.
3. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность.
Ковалентная связь
Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной. Ковалентная связь (означает – «совместно действующая») возникает за счет образования общих электронных пар между атомами в молекуле.
Идея об образовании химической связи с помощью пары электронов, принадлежащих обоим соединяющимся атомам, была высказана в 1916г американским физико – химиком Дж. Льюисом.
Ковалентная связь существует между атомами как в молекулах, так и в кристаллах. Она возникает как между одинаковыми атомами (например, в молекулах Н2, Cl2, О2, в кристалле алмаза), так и между разными атомами (например, в молекулах Н2О и NН3, в кристаллах SiC). Почти все связи в молекулах органических соединений являются ковалентными (С-С, С-Н, С-N, и др.).
Различают два механизма образования ковалентной связи:
1) обменный;
2) донорно-акцепторный.
Обменный механизм образования ковалентной связи заключается в том, что каждый из соединяющихся атомов предоставляет на образование общей электронной пары (связи) по одному неспаренному электрону. Электроны взаимодействующих атомов должны при этом иметь противоположные спины (↓↑).
Рассмотрим для примера образование ковалентной связи в молекуле водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (рис. 3.2), электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы. При очень сильном сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами (длина связи ℓ), при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи Есв.
Н Н Н2
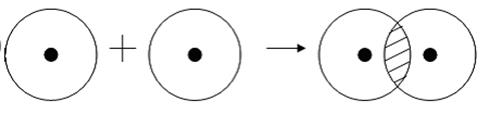
Рис. 3.2. Схема перекрывания электронных облаков при образовании молекулы водорода
Схематично образование молекулы водорода из атомов можно представить следующим образом (точка означает электрон, черта – пару электронов):
Н ∙ + ∙ Н→Н : Н или Н ∙ + ∙ Н→Н – Н .
В общем виде для молекул АВ других веществ:
А ∙ + ∙ В = А : В .
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что одна частица – донор – представляет на образование связи электронную пару, а вторая – акцептор – свободную орбиталь:
А : + В = А : В .
донор акцептор
Рассмотрим механизмы образования химических связей в молекуле аммиака 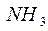 и ионе аммония
и ионе аммония 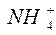 .
.
1. Образование 
Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
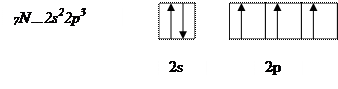

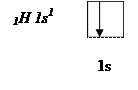 Атом водорода на s – подуровне имеет один неспаренный электрон.
Атом водорода на s – подуровне имеет один неспаренный электрон.
В молекуле аммиака неспаренные 2р – электроны атома азота образуют три электронные пары с электронами 3-х атомов водорода:
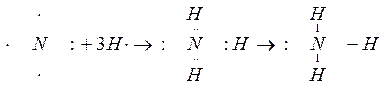 .
.
В молекуле NH3 образованы 3 ковалентных связи по обменному механизму.
2. Образование комплексного иона – иона аммония.
NH3 + HCl = NH4Cl или NH3 + H+ = NH4+
У атома азота остается неподелённая пара электронов 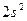 , т. е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода. Неподеленная пара электронов становится общей для атомов азота и водорода, возникает химическая связь по донорно – акцепторному механизму. Атом азота молекулы аммиака является донором, а ион водорода – акцептором:
, т. е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода. Неподеленная пара электронов становится общей для атомов азота и водорода, возникает химическая связь по донорно – акцепторному механизму. Атом азота молекулы аммиака является донором, а ион водорода – акцептором:
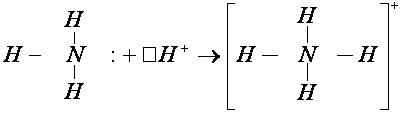 .
.
Следует отметить, что в ионе NH4+ все четыре связи равноценны и неразличимы, следовательно, в ионе заряд делокализован (рассредоточен) по всему комплексу.
Рассмотренные примеры показывают, что способность атома образовывать ковалентные связи обусловливается не только одноэлектронными, но и 2-электронными облаками или наличием свободных орбиталей.
По донорно-акцепторному механизму образуются связи в комплексных соединениях: [BF4]-; [Cu(NH3)4]2+; [Zn(OH)4]2- и т. д.
Ковалентная связь обладает следующими свойствами:
· насыщаемость;
· направленность;
· полярность и поляризуемость.
