Периодический закон д.и.менделеева и строение атома
Периодический закон и Периодическая система Д. И. Менделеева являются наиболее ярким подтверждением всех принципов диалектики. Такие основные законы диалектического материализма, как закон перехода количественных изменений в качественные, закон отрицания, закон единства и борьбы противоположностей с наибольшей наглядностью проявляются в Периодической системе Д. И. Менделеева, которая является графическим выражением Периодического закона. Свойства элементов тесно связаны со строением их атомов. Периодическая повторяемость свойств элементов обусловлена периодическим повторением сходных электронных группировок атомов. Например: все атомы элементов I главной подгруппы Н, Li, Na, К, Rb, Cs, Fr имеют на внешнем энергетическом уровне по одному s-электрону; все атомы элементов II главной подгруппы Be, Mg, Ca, Sr, Ba, Ra - по два s-электрона (это - s-элементы); атомы элементов III главной подгруппы В, Al, Ga, In, Tl - два s-электрона и один р-электрон; атомы элементов IV главной подгруппы С, Si, Ge, Sn, Pb - два s-электрона и два р-электрона (т. е. внешний энергетический уровень атомов IV главной подгруппы имеет одинаковую электронную конфигурацию s2p2). Конфигурация внешнего энергетического уровня атомов элементов V главной подгруппы -s2p3, VI главной подгруппы - s2p4, VII главной подгруппы— s2p5, VIII главной подгруппы -s2p6. Соответственно элементы III— VIII главных подгрупп называются р-элементами и принадлежат к р-электронному семейству. Элементы побочных подгрупп принадлежат к d-электронному семейству. Элементы, следующие за лантаном (лантаноиды) и за актинием (актиноиды), принадлежат к f-электронному семейству.
Химическая природа элемента обусловливается способностью его атома терять и приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
Энергией ионизации называют количество энергии, необходимое для отрыва электрона от невозбужденного атома. Сродством к электрону называют энергетический эффект процесса присоединения электрона к нейтральному атому с превращением его в отрицательно заряженный ион. Энергия ионизации служит мерой металлических и, в первом приближении, восстановительных свойств элементов. Энергия сродства к электрону является мерой неметалллических и косвенно окислительных свойств элементов. Наиболее полную характеристику металлических и неметаллических свойств элементов, а также способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения дает величина, называемая электро-отрицательностью (ЭО). Согласно определению Малликена, ЭО атома может быть выражена как арифметическая полусумма его энергии ионизации и сродства к электрону. Чем больше эта величина, тем в большей степени элемент проявляет неметаллические свойства (табл. 2). Наибольшей ЭО обладает F (4,0), наимень-шей - Cs, Fr (0,7). Значение ЭО металлов ≈ 1,8 и меньше.
В пределах главных подгрупп сверху вниз энергия ионизации, энергия сродства к электрону и ЭО уменьшаются, следовательно, в главных подгруппах сверху вниз увеличиваются металлические свойства элементов, основные свойства гидроксидов и восстановительные свойства соответствующих соеди-нений.
В периодах слева направо энергия ионизации, энергия сродства к элек-трону и ЭО увеличиваются и поэтому происходит постепенное уменьшение металлических и нарастание неметаллических свойств.
Самый активный неметалл F является наиболее сильным окислителем, самые активные металлы Rb, Cs, Fr - наиболее сильными восстановителями, а их гидроксиды - самыми сильными основаниями.
Номер группы, в которой находится элемент, равен высшей степени окисления его атома. Такая степень окисления может проявляться не у всех элементов данной группы (кислород, фтор) Для некоторых элементов (медь, серебро и золото), наоборот, известны соединения, где они проявляют степень окисления большую, чем номер группы. Для неметаллов низшая степень окисления соответствует числу электронов, которые атому необходимо присоединить для образования устойчивой восьмиэлектронной конфигурации. Так, для р-элементов VII, VI, V и IV групп она равна соответственно -1, -2, -3, - 4.
Форма и свойства соединений, образуемых данным элементом, определяют степень окисления его атомов. Так, например, формулы гафниевой Н2НfO3 и курчатовой Н2КuO3 кислот будут аналогичны известной формуле угольной кислоты Н2СO3. Свойства оксидов и гидроксидов зависят от степени окисления образующих их элементов. Если данный элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства последних меняются от основных через амфотерные к кислотным.
Пример 1. Исходя из положения калия, рубидия, брома, селена и азота в периодической системе химических элементов, составьте формулы следующих соединений: бромида калия, селенида рубидия, нитрида кальция
Решение. Перечисленные вещества представляют собой соединения типичных металлов (К, Rb, Ca) с типичными неметаллами (Br, Se, N), в которых последние проявляют низшую степень окисления. К и Rb - элементы 1 главной подгруппы, следовательно, в соединениях они проявляют степень окисления +1. Са – элемент II главной подгруппы проявляет степень окисления +2.
Таблица 2
Относительная электроотрицательность -χ (по Полингу)
| H 2,1 | ||||||
| Li 0,98 | Be 1,5 | B 2,0 | C 2,5 | N 3,07 | O 3,5 | F 4,0 |
| Na 0,93 | Mg 1,2 | Al 1,6 | Si 1,8 | P 2,2 | S 2,6 | Cl 3,0 |
| K 0,91 | Ca 1,04 | Ga 1,8 | Ge 1,8 | As 2,1 | Se 2,5 | Br 2,8 |
| Rb 0,89 | Sr 0,99 | In 1,5 | Sn 1,8 | Sb 1,8 | Te 2,1 | J 2,6 |
| Cs 0,70 | Ba 0,9 | Tl 1,8 | Pb 1,8 | Bi 1,8 | Po 2,0 | At 2,2 |
Низшая степень окисления определяется тем условным зарядом, который приобретает атом, присоединяя такое количество электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки Br, Se, N находятся соответственно в VII, VI и V главных подгруппах и имеют структуру внешнего энергетического уровня 4s24p5; 4s24p4; 2s22p3. Следовательно, низшие степени окисления этих элементов будут равны -1 (Вг), -2 (Se), -3(N).
Исходя из того, что молекулы электронейтральны (т. е. сумма положитель-ных и отрицательных зарядов равна нулю), составляем соответствующие формулы: бромид калия - KBr; селенид рубидия - Rb2Se; нитрид кальция - Ca3N2.
61.Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Образование ионов покажите схемами присоединения соответ-ствующего количества электронов, имеющего место в валентном слое атомов указанных элементов. Составьте формулы соединений алюминия с данными элементами и назовите их.
62. У какого из р-элементов пятой группы Периодической системы – фос-фора или сурьмы – сильнее выражены неметаллические свойства? Почему? Какое из водородных соединений данных элементов является более энергичным восстановителем? Ответ мотивируйте строением атомов этих элементов.
63.Внешние уровни атомов имеют вид 2s22p1; 4s24p3; 5s25p4; 6s1; 7s27p2. В каких периодах и в каких подгруппах находятся эти элементы? К каким электронным семействам они принадлежат?
64. Составьте формулы оксидов и гидроксидов элементов третьего периода Периодической системы, отвечающих их высшей степени окисления. Как изменяется химический характер этих соединений при переходе от натрия к хлору?
65. Исходя из положения германия, цезия и технеция в периодической системе составьте формулы следующих соединений: мета- и ортогерманиевой кислот, дигидрофосфата цезия и оксида технеция, отвечающих их высшей степени окисления. Изобразите графические формулы этих соединений.
66. Что такое энергия ионизации? В каких единицах онавыражается? Как изменяется восстановительная активность s и р-элементов в группах Периодической системы с увеличением порядкового номера? Почему?
67.Внешний и предвнешний уровни атомов элементов имеют следующий вид: 4s24p64d25s2 и 5d106s26p1. В каком периоде и в какой подгруппе находятся каждый из указанных элементов? К каким электронным семействам они относятся? Какова их высшая степень окисления? Составьте формулы оксидов, отвечающих высшей степени окисления этих элементов.
68.С атомом какого р-элемента 8 группы и ионом какого галогена сходен по электронному строению сульфид-ион? Приведите схему заполнения электронами валентных атомных орбиталей.
69.С атомами каких элементов сходны по электронному строению ионы Cr3+, Al3+, S+4? Приведите схемы заполнения электронами энергетических уровней и подуровней валентного слоя указанных ионов.
70. Что такое электроотрицательность? Как изменяется электроотрицатель-ность р-элементов в периодах и группах Периодической системы с увеличением порядкового номера?
71. Исходя из положения германия, молибдена и рения в Периодической системе, составьте формулы следующих соединений: водородного соединения германия, рениевой кислоты и оксида молибдена, отвечающих их высшей степени окисления. Изобразите графические формулы этих соединений.
72. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и в группе Периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента.
73. Какой из элементов четвертого периода - ванадий или мышьяк – облада-ет более ярко выраженными металлическими свойствами? Какой из этих элемен-тов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов.
74. Какие элементы образуют газообразные соединения с водородом? В ка-ких группах Периодической системы находятся эти элементы? Составьте форму-лы водородных и кислородных соединений хлора, теллура и сурьмы, отвечающих их низшей и высшей степеням окисления.
75. У какого элемента четвертого периода хрома или селена сильнее выра-жены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атома хрома и селена.
76. Определите по следующему описанию: а) щелочной металл, у которого валентным является 4s1- электрон; б) благородный газ, содержащий на внешнем энергетическом уровне меньше восьми электронов; элементы с одним неспарен-ным 2р-электроном; г) самый легкий элемент, внешний энергетический уровень которого содержит рх ру рz электроны. Приведите полные электронные формулы атомов найденных элементов.
77. Почему марганец проявляет металлические свойства, а хлор - неметалл-лические? Ответ мотивируйте строением атомов этих элементов. Напишите фор-мулы оксидов и гидроксидов хлора и марганца.
78. Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой их степени окисления. Как называются соответствующие соединения?
79. Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
80. Какова современная формулировка Периодического закона? Объясните, почему в Периодической системе элементов аргон, кобальт, теллур и торий поме-щены соответственно перед калием, никелем, йодом и протактинием, хотя и име-ют большую атомную массу?
5. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ. СВОЙСТВА ВЕЩЕСТВ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ
При взаимодействии атомов между ними возникает химическая связь, при-водящая к образованию устойчивой многоатомной системы - молекулы, молеку-лярного иона, кристалла.
Причина возникновения химической связи обусловлена тем, что обра-зование молекул сопровождается выигрышем энергии.
Различают ковалентную, ионную и металлическую связи. Для описания химических связей в настоящее время наибольшее распространение получил упрощенный полуэмпирический метод - метод валентных связей (ВС). В основе этого метода лежат представления квантовой механики.
Связь, образованную общими электронными парами, называют кова-лентной. Эта связь - двухцентровая, двухэлектронная. Основные свойства кова-лентной связи - насыщаемость, направленность, поляризуемость. Насыщаемость ковалентной связи объясняется наличием у атома того или иного элемента определенного числа неспаренных электронов. Валентность, определяемую общим числом имеющихся в атоме неспаренных электронов или образующихся при его последовательном возбуждении, называют спин-валентностью.
У атомов большинства элементов число валентных электронов может изменяться в зависимости от того, находится атом в основном или возбужденном состоянии. Например, атом серы может проявлять переменную валентность. Схема распределения электронов внешнего уровня атома серы по квантовым ячейкам
16S
| ↑↓ | ↑↓ | ↑ | ↑ |
3s2 3p4 3d0
т.е. число неспаренных электронов - 2, валентность равна 2.
Атом серы имеет свободные d-орбитали, для него возможны возбужденные состояния, сопровождающиеся переходом одного Зр-электрона и одного 3s-элек-трона на 3d-подуровень с увеличением числа валентных электронов:
16S*
| ↑↓ | ↑ | ↑ | ↑ | ↑ |
3s2 3p3 3d1
число неспаренных электронов - 4, валентность - 4;
16S**
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑ |
3s1 3p3 3d2
число неспаренных электронов - 6, валентность - 6.
В отличие от атома серы, у атомов кислорода как элемента второго периода отсутствует d-подуровень, возбужденного состояния нет. Схема распределения электронов внешнем энергетическом уровне атома кислорода:
8О
| ↑↓ | ↑↓ | ↑ | ↑ |
2s2 2p2,
число неспаренных электронов - 2, валентность - 2.
Направленность ковалентной связи обусловливается тем, что электронные облака атома имеют определенную конфигурацию и расположение в пространстве.
Метод ВС предполагает участие в образовании ковалентных связей не только «чистых» атомных орбиталей, но и «смешанных», так называемых гибридных АО. При гибридизации первоначальная форма и энергии орбиталей (электронных облаков) взаимно изменяются, и образуются орбитали новой оди-наковой формы и одинаковой энергии. Число гибридных орбиталей равно числу исходных. Например, при смешивании одной s- и одной р-орбитали происходит sp-гибридизация, за счет которой образуются две так называемые q-орбитали, расположенные под углом 180°. При смешивании одной s-орбитали и двух р-орбиталей (sр2-гибридизация) образуется три гибридных q-орбитали, располо-женные в одной плоскости, под углом 120°. При sp3-гибридизации четыре q-орби-тали расположены под углом 109°28/(тетраэдр), а при sp3d2-шесть q-орбиталей расположены под углом 90° (октаэдр).
Поляризуемость ковалентной связи объясняется различной электроотри-цательностью образующих молекулу атомов. Электронное облако связи (электронная пара) сдвигается к более электроотрицательному атому, и в молекуле образуется смещение центров тяжести положительных и отрицательных зарядов. Такие молекулы называют диполями. Расстояние между центрами тяжести положительного и отрицательного зарядов называют длиной диполя. Полярность молекулы, как и полярность связи, оценивают величиной ее дипольного момента, представляющего собой произведение длины диполя на абсолютное значение заряда электрона: 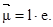
Чем больше различие в электроотрицательности двух элементов, тем более полярна химическая связь между их атомами. Ионный тип связи можно рассматривать как крайний случай полярной ковалентной связи. Так, при взаимодействии щелочных и щелочно-земельных металлов с типичными неме-таллами (например с галогенами) образующиеся соединения (галогениды) отно-сятся к соединениям с ионным типом связи (NaCl, CsF, KBr и т. д.). Связь такого типа осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов. Но при этом следует иметь в виду, что даже в этих соединениях не происходит полного разделения отрицательного и положительного зарядов, т. е. полного перехода электрона от одного атома к другому.
По способу перекрывания электронных облаков различают σ-, π- и δ-связи. Если перекрывание электронных облаков идет по линии, соединяющей центры взаимодействующих атомов, то такую связь называют σ-связью. Если перекрывание электронных облаков идет перпендикулярно линии, соединяющей ядра атомов по обе стороны от нее, то связь называют π-связью. Если d-элек-тронные облака, расположенные в параллельных плоскостях, перекрываются всеми четырьмя лепестками, то такую связь называют δ-связью. В молекулах кислорода, азота, содержащих двойные и тройные связи, имеются σ- и π-связи.
Ковалентная связь может образовываться также по донорно-акцепторному способу. Связь, которая осуществляется за счет неподеленной электронной пары одной из частиц (донора) и свободной квантовой ячейки другого атома (акцептора), называют донорно-акцепторной или координационной. Этот тип связи имеет место в комплексных соединениях.
Водородная связь обусловлена тем, что атом водорода, химически связанный в одной молекуле с атомом элемента с высокой ЭО (например, фтора, кислорода или азота), может соединяться еще с атомом этого же элемента или другим подобным атомом из другой молекулы. Водородную связь обозначают пунктиром, например
Н—F---H—F---H—F.
Водородная связь занимает промежуточное положение между электростатическим притяжением и донорно-акцепторным взаимодействием; она менее прочна, чем обычная химическая, но оказывает влияние на многие свойства веществ, является причиной ассоциации молекул воды, фтористого водорода, уксусной кислоты, что затрудняет отрыв их молекул друг от друга и служит причиной аномально высоких температур плавления и кипения этих веществ.
Учение о химической связи - центральная проблема современной химии. Не зная природу взаимодействия атомов в веществе, нельзя понять причины многообразия химических соединений, их свойств, строения и реакционной способности. В обычных условиях атомы и молекулы не существуют индивидуально. Они всегда составляют только части более высокой организации вещества, практически участвующего в химических превращениях.
Пример 1.Составьте электронную схему молекулы НСl. Как изменяется полярность связи в ряду НСl→ HBr→ HI ?
Решение. В электронных схемах электроны, находящиеся на внешнем энер-гетическом уровне, обозначают точками, расположенными вокруг химического символа атома. Общие для двух атомов электроны показывают точками, расположенными между их химическими символами:
I7C1 …. .3s23p5
| ↑↓ | ↑↓ | ↑↓ | ↑ |
3s2 3p5 3d0
1H 1s1 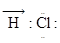
| ↑ |
В ряду НСl→ HBr→HI полярность связи будет уменьшаться. Это связано с уменьшением разности электроотрицательности атомов при переходе от НСl к НВг и HJ (табл. 2):
ΔЭОНСl = 3,0 - 2,1 = 0,9; ΔЭОНВг = 2,8 -2,1 = 0,7; ΔЭОНJ = 2,6 - 2,1 = 0,5.
81.Распределите электроны атома азота и фосфора по квантовым ячейкам. Объясните, почему с точки зрения спин-валентности для азота пятивалентное состояние невозможно, а для фосфора – возможно.
82.Какая из следующих связей полярна? Укажите для каждой полярной связи более электроотрицательный атом и связи расположите в порядке возрастания степени их полярности: а) Cl-J; б) P-P; в) C-N; г)F-F; д) O-H.
83.Какую ковалентную связь называютσ-, π-, δ-связью?Как метод ВС объясняет строение молекул водорода, фтора и азота? Приведите схемы перекры-вания орбиталей в них.
84. Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
85. Какая ковалентная связь называется неполярной и какая полярной? Что служит количественной мерой полярности ковалентной связи? Составьте электронные схемы строения молекул N2, Н2О, HBr. Какие из них являются диполями?
86. Какой способ образования ковалентной связи называется донорно-акцепторным? Какие химические связи имеются в ионах NH4+ и ВF4? Укажите донор и акцептор.
87. Как метод валентных связей (ВС) объясняет линейное строение молекулы ВеС12 и тетраэдрическое — метана СН4?
88. Какая ковалентная связь называется σ-связью и какая π-связью? Разберите принцип и механизм образования этих видов связи на примере молекулы азота.
89. Распределите электроны атома брома по квантовым ячейкам. Сколько не-спаренных электронов имеют его атомы в основном и возбужденном состояниях? Чему равна валентность брома, обусловленная неспаренными электронами?
90. Что называется дипольным моментом? Какая из молекул НС1, НВг, HJ имеет наибольший дипольный момент? Почему?
91. Какова форма молекул ВН3 и NH3? Покажите схему перекрывания в этих молекулах электронных облаков.
92. Составьте электронные схемы строения молекул С12, Н2Se, ССl4. В каких молекулах ковалентная связь является полярной? Как метод валентных связей (ВС) объясняет угловое строение молекулы сероводорода и тетраэдрическое строение СCl4?
93. Какой тип связи в молекулах PН3, HF, F2 и СаО? Объясните механизм образования связей между атомами в этих молекулах.
94. Какая химическая связь называется водородной? Между молекулами ка-ких веществ она образуется? Почему Н2О и НF, имея сравнительно небольшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги- H2S и HCl?
95. Какая химическая связь называется ионной? Каков механизм ее образова-ния? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соот-ветствующих ионов в нейтральные атомы.
96.Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспарен-ных электронов, в соединениях СН4, СН3ОН, НСООН, СО2.
97.Приведите примеры веществ, в которых связи носили бы характер:
а) ионный; б) ковалентный – полярный и неполярный; в) координативный (донор-но-акцепторный); г) межмолекулярные водородные связи. Дайте мотивированный ответ.
98.Химические связи С-О и Н-О полярны. Представьте строение молекул СО2 и Н2О графически и дайте мотивированный ответ, почему молекула СО2 имеет линейное строение и неполярна, а Н2О – имеет угловое строение и является диполем.
99.Изобразите геометрическое строение молекул диоксида и триоксида серы. Чем объяснить различие в симметрии этих молекул? Почему активность серы в реакциях присоединения значительно выше, чем у триоксида серы. Имеется ли в этом случае корреляция между строением молекул и реакционной способностью?
100.Известно, что в атомах бериллия и бора 2р-орбитали расположены вдоль осей x, y и z с углами между ними по 90о. Почему молекула BeF2 - линейная (а не угловая), а молекула BF3 - плоская (а не пирамидальная)?
