Литийорганические соединения
Для литийорганических соединений характерна наиболее высокая полярность связи углерод-металл. В предельном случае связь может стать полностью ионной, т.е. соединение распадается на карбанион и катион металла.
В малополярных растворителях литийорганические соединения склонны к агрегации. Например, метиллитий - гексамерен при растворении в углеводородах (МеLi)6 и тетрамерен (МеLi)4 при растворении в тетрагидрофуране, диэтиловом эфире:
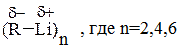
Агрегация метиллития в безводных апротонных растворителях
В растворах олигомеры литийорганических соединений находятся в равновесии с сольватированными мономерами, например, в эфире:
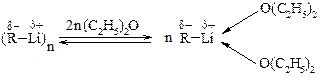
Рис. 21.6. Схема равновесие олигомеров и сольватированных мономеров
Литийорганических соединений в безводных апротонных растворителях
В сильнополярных апротонных растворителях возможна ионизация с образованием карбанионов:
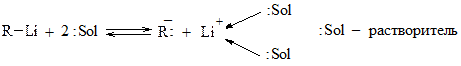
Рис. 21.7. Ионизация литийорганических соединений в сильнополярных апротонных растворителях с образованием карбаниона и катиона лития
Магнийорганические соединения
1. Доказано, что структура магнийорганических соединений включает координационно связанные с атомом Mg молекулы растворителя – диэтилового эфира. 2. Это обеспечивает растворимость реактивов Гриньяра.
3. Реактивы Гриньяра прочно удерживают молекулы растворителя,а при удалении реактивов Гриньяра обычно разрушаются:
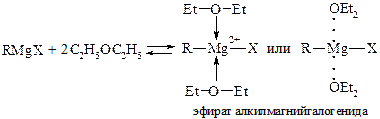
Рис. 21.8. Структура растворимых реактивов Гриньяра, сформировавшаяся в результате образования координационных связей между атомом Mg и молекулами диэтилового эфира (растворителя)
В действительности в растворах магнийорганические соединения представляют собой более сложную смесь, состоящую из:
- сольватированных молекул реактива Гриньяра типа RMgХ;
- молекул реактива Гриньяра типа R2Mg;
- олигомеров молекул магнийорганического соединения.
Согласно Шленку существует равновесие:
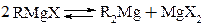
Рис. 21.9. Равновесие Шленка
Независимо от строения соединения в растворе пользуются обычно простой формулой RMgХ.
Химические свойства.
1. Химические свойства литийорганических соединений определяются сильной полярностью связи металл-углерод, атом углерода обладает значительной электроотрицательностью по отношению к атому лития.
2. В связи с этим литийорганические соединения являются сильнейшими
С-основаниями и С-нуклеофилами.
3. Следовательно, для них характерны реакции с протонодонорными соединениями (кислотами) и другими электрофильными реагентами.
4. Свойства магнийорганических соединений (RMgХ), в основном, подобны свойствам литийорганических соединений, т.е. во многом определяются полярностью связи С–Mg, только активность магнийорганических соединений ниже по сравнению с литийорганическими.
Rδ-←Mgδ+→Хδ-
– здесь атом углерода несет избыточную электронную плотность (δ-), но сам атом углерода не обладает сильной электроотрицательностью. По этой причине он легко подвергается атаке со стороны электрофильных реагентов. Это и определяет свойства магнийорганических соединений как оснований и нуклеофилов.
