Гидролиз органических веществ
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например,в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты, жиры — на глицерин и жирные кислоты, полисахариды (например, крахмал и целлюлоза) — на моносахариды(например, на глюкозу), нуклеиновые кислоты — на свободные нуклеотиды.
При гидролизе жиров в присутствии щёлочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицерина и жирных кислот. Гидролизом древесины получают этанол, а продукты гидролиза торфа находят применение в производстве кормовых дрожжей, воска, удобрений и др.
Маскировка - связывание мешающих ионов в малодиссоциированные комплексные соединения при обнаружении, определении и отделении каких-либо компонентов анализируемого объекта.
С целью маскировки мешающие ионы переводят в устойчивые комплексы, изменяют валентность этих ионов при помощи окислителей или восстановителей, изменяют рН среды и т. д.
Маскирование – это торможение или полное подавление химической реакции в присутствии веществ, способных изменить ее направление или скорость.
Проблема маскирования имеет непосредственное отношение к одной из важнейших задач современной аналитической химии — повышению избирательности аналитических реакций и реагентов. Один из путей решения данного вопроса — синтез новых органических реагентов. Многолетний опыт исследований убеждает, что крупная аналитическая проблема может быть успешно решена только в результате применения комплекса различных методов. Одним из перспективных методов является метод маскирования.
Цель маскирования — устранить влияние присутствующих в растворе веществ на реакции обнаружения или количественного определения какого-либо элемента. Маскирование — наиболее эффективный прием повышения селективности аналитических реакций, он широко используется в практике химического анализа. Его преимущество по сравнению с методами отделения мешающих веществ посредством осаждения, экстракции, отгонки и др. состоит в экспрессности: не нужно затрачивать время на операции фильтрования и промывания осадков, разделения фаз и т.д.
При этом не происходит образования новой фазы, в чем и состоит основное преимущество маскирования перед разделением, поскольку исключаются операции, связанные с отделением фаз друг от друга.
2 вида маскирования:
–термодинамическое(равновесное)
- кинетическое (неравновесное).
Термодинамическое маскирование -создают условия, при которых условная константа реакции понижается до такой степени, что реакция идет незначительно. Концентрация маскируемого компонента становится недостаточной для того, чтобы надежно зафиксировать аналитический сигнал.
Кинетическое маскирование основано на увеличении разницы между скоростями реакции маскируемого и определяемого веществ с одним и тем же реагентом. Например, индуцированная реакция 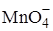 с
с 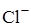 в присутствии Fe(II) замедляется в присутствии фосфат-ионов.
в присутствии Fe(II) замедляется в присутствии фосфат-ионов.
Влияние кинетики реакции рассматривается далее. Здесь внимание уделяется термодинамике процесса.
Введем некоторые обозначения. В процессе маскирования различают препятствующее определению вещество Y, определяемое вещество X, аналитический реагент R и маскирующий агент L(HL).
Вещества Х и Y во многих случаях представляют собой катионы метал лов, реже — незаряженные молекулы или анионы кислот.
Цель маскирования — устранить или предупредить протекание реакции между Y и R:
Y+ R → А + В, (1)
с тем чтобы это не отразилось на реакции X с R:
X + R →Р, (2)
которая должна протекать количественно.
Замаскировать реакцию (1) можно несколькими способами.
1. Сдвинуть равновесие реакции (1) практически полностью влево. Этого можно достигнуть следующими приемами:
а) Введение в систему заблаговременно большого избытка продуктов реакции А или В. Так, реакцию
Ce(IV)+ AsО2→ Се (III) + AsO2
можно устранить, вводя предварительно большой избыток AsO. Такой прием применяется сравнительно редко.
б) Изменение концентрации водородных ионов раствора. Этот прием эффективен в тех случаях, когда реагент имеет кислотный или основный характер и его взаимодействие с X сопровождается выделением (или поглощением) протонов:
X + HR → XR + H+. (3)
Если реагент вступает в реакцию с Y:
Y + HR → YR + Н +, (4)
то последнюю можно ограничить увеличением концентрации ионов водорода до такого предела, когда равновесие реакции (4) практически полностью сдвинуто влево, но в то же время реакция (3) идет практически полностью в правую сторону. В качестве маскирующего агента в данном случае выступают ионы водорода при определенной величине их концентрации в растворе. Так, фосфаты многих металлов нерастворимы в воде. Из нейтральных растворов осаждаются совместно, например, фосфаты железа и меди. Выделение осадка Cu3(P04)2 можно предотвратить, создав в растворе посредством ацетатного буфера рН 4—5. Таким способом можно отделить железо от меди и ряда других двухзарядных ионов металлов.
2. Сдвинуть равновесие реакции (2) путем уменьшения концентрации Y под влиянием введенного маскирующего агента (Ox, Red, HL, L).
Маскирующий агент понижает концентрацию Y в растворе; степень этого понижения должна быть такова, чтобы предотвратить взаимодействие Y с реагентом R при доступной вследствие маскирования концентрации Y. В общем случае выгодно, чтобы равновесие реакции между Y и маскирующим агентом было как можно больше сдвинуто в сторону образования соответствующего продукта реакции.
Маскирующий агент может реагировать также с определяемым катионом X и снижать его концентрацию в растворе. Тем не менее концентрация X в растворе после маскирования должна быть достаточна для того, чтобы реализовать взаимодействие X с R и достичь желаемого эффекта аналитической реакции.
Здесь возможны следующие варианты.
а) Изменение окислительного состояния постороннего вещества. Предварительное окисление или восстановление мешающего элемента Y в анализируемой смеси приводит к образованию продукта реакции, который уже не взаимодействует с реагентом R; маскирующим агентом в данном случае выступает химическое соединение — окислитель или восстановитель (или постоянный электрический ток).
Восстановление Y до более низкой степени окисления можно представить уравнением
Y + Red→YRed. (5)
В качестве восстановителей применяют тиосульфат натрия, хлорид гидроксиламина, гидразин, аскорбиновую кислоту, хлорид олова. Метод пригоден для маскирования As(V), Fe(III), Cr(VI), Ce(IV), V(V), Cu(II) и др. Так, при фотометрическом определении кобальта в виде тиоцианатного комплекса катионы железа можно восстановить до степени окисления 2+ хлоридом олова (II) и устранить, таким образом, его мешающее влияние на определение кобальта.
Можно также окислить Y до более высокой степени окисления в соответствии со схемой
Y + Оx→YOx. (6)
Окислителями могут быть КМп04, К2Сг207 и др. Их применяют для маскирования Sb (III), Cr (III), анионов C2O4, и др.
б) Связывание мешающего определению элемента Y в растворимое комплексное соединение с лигандом L.
Y + L →Р. (7)
Это наиболее распространенный прием маскирования. Маскирующим агентом может быть любой органический или неорганический лиганд, образующий устойчивое комплексное соединение с Y. Естественно, что маскирующий лиганд не должен затруднять или устранять взаимодействие определяемого вещества X с реагентом R. Если маскирующий лиганд -анион слабой кислоты (или катион слабого основания), то связыванию Y вкомплекс с L будет благоприятствовать увеличение рН раствора:
Y + HL → YL + H+. (8)
Маскирование, основанное на реакциях комплексообразования, — наиболее важный и широко распространенный прием повышения селективности аналитических реакций.
Для такого маскирования можно привести другое определение: маскирование — процесс химического превращения вещества, в результате которого предупреждаются или устраняются некоторые аналитические реакции данного вещества и, как правило, не происходит выделения каких-либо веществ в другую фазу. Тем не менее иногда к реакциям маскирования относят также реакции непосредственного осаждения (или экстракции) мешающих ионов, после чего определяют в растворе элемент X с помощью реагента R. Это справедливо в тех случаях, когда образующийся осадок выделяется в такой форме, которую можно оставить в анализируемом растворе, не затрудняя дальнейшее определение. Так, при рН < 12 кальций может быть оттитрован этилендиаминтетрауксусной кислотой (ЭДТА) в присутствии ионов магния, которые осаждаются в виде гид рок си да. Однако если осадок необходимо предварительно отделить фильтрованием, такую операцию нельзя отнести к реакциям маскирования.
В зависимости от аналитических свойств продуктов взаимодействия X с R различают несколько типов маскируемых реакций.
Маскирование образования окрашенных соединений.Этот тип маскируемых реакций распространен в тех случаях, когда при взаимодействии Y с R образуется окрашенное соединение, цвет которого мешает наблюдать и измерить поглощение света продуктом заключительной аналитической реакции между X и R. Естественно, что сам маскирующий агент не должен быть окрашен или его полоса поглощения должна располагаться в другой области спектра.
Примером может служить обнаружение или определение индия с помощью ализарина в присутствии алюминия, который дает цветную реакцию с реагентом. Маскирование осуществляют введением ионов фтора, которые предупреждают образование окрашенного комплекса алюминия с ализарином, не ослабляя в то же время заметно окраски комплекса индия.
Маскирование реакций осаждения. Малорастворимый осадок, образующийся при реакции Y с R, мешает гравиметрическому определению X с R. В этом случае необходимо устранить осаждение продукта реакции Y с R. Так, сероводород в кислой среде образует осадки сульфидов олова(1У) и сурьмы(Ш). Связывая олово щавелевой кислотой, переводят его в растворимый оксалатный комплекс, из которого сероводород не осаждает более сульфида олова SnS2.
Маскирование при экстракционном разделении ионов.В качестве примера приведем экстракционное разделение алюминия и титана посредством хлороформного раствора 8-оксихинолина. Экстракцию титана можно замаскировать введением раствора пероксида водорода, образующего с титаном устойчивый пероксидный комплекс. Оксихинолинат алюминия переходит в органическую фазу.
Маскирование элементов при определении электрохимическими методами.В полярографическом анализе можно замаскировать или устранить появление диффузионной волны мешающего элемента. Так, индий и кадмий восстанавливаются на ртутном капельном электроде почти при одинаковых потенциалах полуволны и образуют вследствие этого одну общую волну. Введение иодида калия способствует переводу кадмия в иодидный комплекс, который восстанавливается при значительно более отрицательном потенциале, чем индий, что создает возможность, раздельного полярографического определения обоих элементов.
В электрогравиметрическом анализе определение кадмия в присутствии меди основано на маскировании последней цианидом калия. Кадмий также образует растворимый цианидный комплекс, однако при некотором определенном значении приложенного напряжения из раствора на катоде осаждается только металлический кадмий. Медь остается в растворе в виде комплекса К3 [Cu(CN)4].
Существуют и другие типы реакций, в которых только приемы маскирования обеспечивают избирательность определения элементов.
Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс
(от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомыокислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные частиПри этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
