Тема 3. Химическое равновесие
Введение. Простая по сути, но удивительно занудная тема. Перепутать уменьшение с увеличением, а сдвиг равновесия влево со сдвигом вправо и зафейлить то, что вы поняли – пустяковое дело. Будьте бдительны!
Надо отметить на всякий случай, как влияют разные факторы на сдвиг равновесия.
Условные знаки: ↑-увеличивается, ↓- уменьшается, →-смещается вправо, ←-смещается влево, Кс – константа химического равновесия, Т- температура, Р – давление, с – концентрация.
1) Влияние температуры
А) Если реакция ΔН>0 эндотермическая, то при ↑Т равновесие → и Кс↑
при ↓Т равновесие ← и Кс ↓
Б) Если реакция ΔН<0 экзотермическая, то при ↑Т равновесие ← и Кс ↓
при ↓Т равновесие → и Кс↑
2) Влияние давления.
А) При ↑Р равновесие смещается в сторону образования меньшего количества газов. Например, для реакции N2 (газ) + 3 H2 (газ) = 2 NH3 (газ), с ↑ давления равновесие смещается вправо, потому что слева 4 молекулы газов (3+1), а справа только 2.
Б) При ↓Р равновесие сместится в сторону образования большего количества газов.
Внимание! Жидкости и твердые вещества не считаются за газы! Неожиданно, правда? Если газов в разных частях реакции поровну, тогда давление не будет влиять на такую реакцию. Р не влияет на Кс вообще никогда, иногда задают такой вопрос.
3) Влияние концентраций
При ↑с(исх веществ) равновесие →
При ↓с(исх веществ) равновесие ←
При ↑с(продуктов) равновесие ←
При ↓с(продуктов) равновесие →
Концентрция не влияет на Кс
4) Влияние катализатора
Не влияет на сдвиг равновесия и Кс
Типичные вопросы:
1. Кс и Пс, направление реакции.
Пример:

Самая жесть этой темы. Обратите внимание, концентрации твердых веществ не даны, потому что они не ставятся в формулу, а в жизни не имеют смысла. Концентрация может применяться только к растворенному веществу, а твердое вещество – не растворено. Пс=0,01/0,05=0,2. Пс<Кс, ну и вывод…?
Как с этим бороться:
Самый сложный вопрос. Алгоритм действий подробно описан в голубой методичке, могу его только просто повторить. 1. Рассчитываем 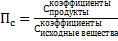 , то есть концентрации продуктов, в степенях, равных коэффициентам, разделить на концентрации исходных веществ, тоже в степенях, равных коэффициентам. Например, для реакции 2 NO + O2 = 2 NO2 оно будет рассчитываться так: Пс=с(NO2)2/ с(NO)2с(О2). Внимание, концентрации даны дурацким способом, не перепутайте, где чья концентрация. Внимание! Степени не потеряйте! Потом сравниваем рассчитанное Пс с данным Кс. Если Пс>Kc то реакция идет влево, если Пс<Kc то реакция идет вправо, если Пс=Kc реакция находится в равновесии.
, то есть концентрации продуктов, в степенях, равных коэффициентам, разделить на концентрации исходных веществ, тоже в степенях, равных коэффициентам. Например, для реакции 2 NO + O2 = 2 NO2 оно будет рассчитываться так: Пс=с(NO2)2/ с(NO)2с(О2). Внимание, концентрации даны дурацким способом, не перепутайте, где чья концентрация. Внимание! Степени не потеряйте! Потом сравниваем рассчитанное Пс с данным Кс. Если Пс>Kc то реакция идет влево, если Пс<Kc то реакция идет вправо, если Пс=Kc реакция находится в равновесии.
2. Смещение равновесия при влиянии давления.
Пример:
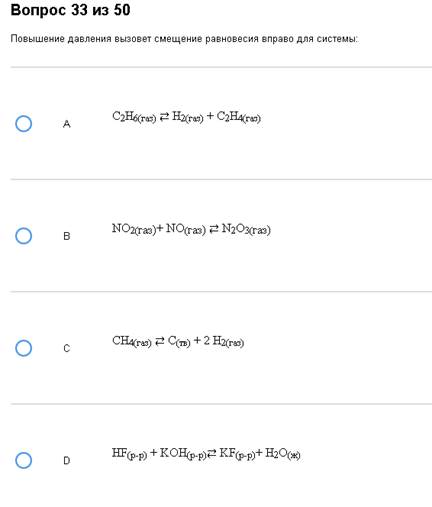
Геморрой. Верно – В. Обратите внимание на D, там вообще нет газов.
Как с этим бороться:
Все описано во введении, главное не перепутайте повышение и понижение давление, а из веществ смотрите только на газы.
3. Смещение равновесия при влиянии температуры, ΔН, Т, Кс и смещение равновесия.
Пример:

Пример как раз обратного рассуждения, если при ↑Т Кс↑, то реакция…?
Как с этим бороться:
Опять же, все описано во введении. Верны будут как прямые суждения, типа «для экзотермической реакции при повышении температуры константа равновесия уменьшается», так и обратные типа «если для реакции при повышении температуры константа равновесия уменьшается, то реакция экзотермическая». Чтобы жизнь не казалась слишком легкой, придумали такое усложнение: иногда спрашивают про энтальпию не прямой, а обратной реакции. Например, для некоей обратимой реакции с ростом температуры константа равновесия увеличивается. Ежу понятно, прямая реакция эндотермическая. А вот обратная реакция – экзотермическая. Будьте бдительны, враг не дремлет.
4. Смещение равновесия при влиянии концентраций.
Пример:
Сорян, забыл заскринить.
Как с этим бороться:
См. введение, тут вроде бы без переподвыподвертов.
5. Неизвестный пока науке вопрос.
Пример:
нету
Как с этим бороться:
Пока неизвестно.
Тема 4. Осмос.
Введение. Очень легкая тема. Расчеты строятся на формуле сосм=i·c, где сосм – осмолярность, c – молярная концентрация, а i – изотонический коэффициент Вант-Гоффа, собственно самая соль этой темы. i равен количеству ионов, на которые распадается электролит при диссоциации. Например, для NaCl i=2, для CaCl2 i=3 (кальций и два иона хлора), для Na2SO4 тоже i=3, для K3PO4 i=4. Для слабых электролитов (HNO2, CH3COOH) i является дробным числом больше одного но меньше 2, приблизительно 1,3. Для неэлектролитов (С6Н12О6, сахароза, мочевина (NH2)2CO) i=1. Чем больше с и i, тем больше осмолярность. Осмотическое давление рассчитывается π=сосмRT, где π – осмотическое давление, кПа, R=8,31, Т = температура в градусах Кельвина.
Типичные вопросы:
1. Верные-неверные утверждения
Пример:
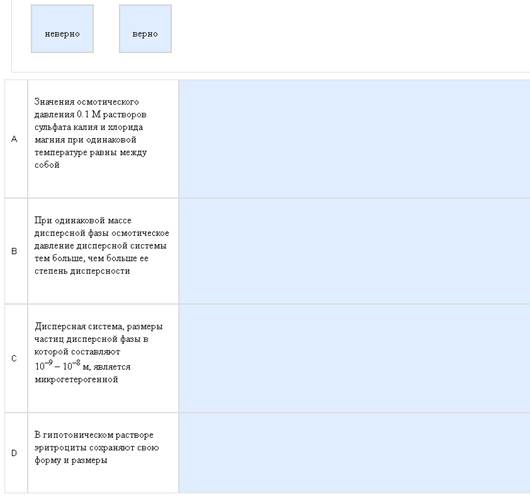
Очередная угадайка.
Как с этим бороться:
Никак. Как всегда никак. По примеру: А-верно, если прочитать введение, следующий вопрос и подумать, то можно догадаться почему, В-верно, часто это вижу, и таки да, чем больше степень дисперсности, тем больше осмотическое давление. Аналогично еще попадаются гидролизующийся белок, там с течением времени осмотическое давление возрастает и полимеризующаяся какая то фигня, там наоборот, осмотическое давление падает. С-неверно, такие размеры у ультрамикрогетерогенных систем, микрогетерогенные 10-4 – 10-5. D-неверно, в изотоническом растворе эритроциты сохраняют форму и размер. В гипотоническом они набухают (лизис), в гипертоническом сморщиваются (плазмолиз). Зато все остальное – элементарно.
2. Изо-, гипо- и гипертонические растворы.
Пример:
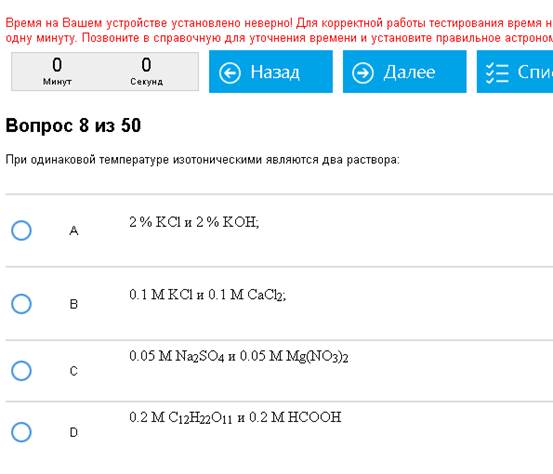
Верно – С. 0,05*3=0,05*3.
Как с этим бороться:
Изотонические растворы – растворы с одинаковой осмолярностью. Если у одного раствора давление больше то он гипертонический, а у другого раствора меньше и он гипотонический. В основном стоит задача найти пару изотонических растворов. Лихо определяем коэффициенты i для приведенных веществ, перемножаем их на данные концентрации (цифры там обычно такие, что все это можно и в уме сделать), получаем осмолярности, сравниваем, находим два одинаковых – ура-ура.
3. Изменение осмотического давления (осмолярности) в ряду.
Пример:

Коэффициенты i по веществам равны 1, 2 и3, ряд осмолярностей получается 0,2*1<0,2*2<0,2*3, возрастает.
Как с этим бороться:
Полный аналог предыдущего по способу решения, чуть иная форма. Определяем коэффициенты i, перемножаем их на концентрации и смотрим, как меняется осмолярность в полученном ряду.
4. Пока неизвестный науке тип вопроса.
Пример:
?
нету.
Как с этим бороться:
Пока неизвестно.
