Реактивы и оборудование
Бюретки на 25 мл в штативе, химические воронки, пипетки Мора на 5мл и 10мл, колбы конические для титрования на 100мл,резиновые груши,стаканчики для слива; предметное стекло, стандартный 0,02н раствор бихромата калия K2Cr2O7 , 5%-ный раствор иодида калия КI, 1н раствор серной кислоты H2SO4. раствор тиосульфата натрия Na2S2O3, раствор сульфата меди CuSO4
К определенному количеству титрованного раствора K2Cr2O7 приливают КI в кислой среде. Выделившийся йод оттитровывают раствором тиосульфата натрия. Реакции протекают по уравнению:
Ход определения
Приступая к титрованию, наполняют бюретки раствором Na2S2O3 и устанавливают уровень жидкости в ней на 0. В колбу для титрования мерным цилиндром или градуированной пробиркой вносят 1–2 мл 5%-ного раствора КI и 2–3 мл 1н раствора H2SO4. Затем к полученной смеси пипеткой Мора добавляют 5 мл 0,02н раствора K2Cr2O7 (кончик пипетки при этом не должен касаться смеси). Полученную смесь слегка перемешивают, колбу закрывают часовым или предметным стеклом, чтобы предупредить потери от улетучивания йода и оставляют для завершения реакции на 5 минут. Выделившийся йод титруют тиосульфатом натрия (Na2S2O3) до светло-желтой окраски, затем прибавляют 4–5 капель крахмала и продолжают титровать до перехода синей окраски в бледно-зеленую или бесцветную от одной капли раствора тиосульфата натрия. Последние капли прибавляют медленно, хорошо перемешивая раствор. Титрование повторяют 2–3 раза. Из полученных результатов (разность не более 0,1 мл) берут среднее значение для расчетов. Данные заносят в таблицу 1.
Таблица 1.
Результаты опыта.
| № | V(K2Cr2O7) | N(K2Cr2O7) | V(Na2S2O3) | N(Na2S2O3) | T(Na2S2O3) |
| ср |
Работа №2. Определение массовой доли меди в медном купоросе методом иодометрии.
Йодометрическое определение меди в медьсодержащих веществах основано на взаимодействии катионов Cu2+ с анионом I-.
2CuSO4 + 4KI → 2CuI + I2 + 2K2SO4
Выделившийся свободный I2 (заместитель Cu2+) титруется рабочим раствором тиосульфата натрия:
I2 + 2Na2S2O3 ↔ 2NaI + Na2S4O6
Ход определения:
В колбу для титрования объемом 100 мл последовательно внести 5 мл 5%-го раствора иодида калия и 5 мл анализируемого раствора медного купороса, накрыть смесь в колбе часовым стеклом и поставить в темное место на 10 мин для завершения реакции, т.е. до полного окисления иодид-иона в свободный иод. Выделившийся иод оттитровать раствором тиосульфата натрия до перехода темно-бурой окраски в соломенно-желтую. Прилить в колбу 3-5 капель 1%-ного раствора крахмала и быстро, но по каплям закончить титрование, признаком чего служит исчезновение синей окраски крахмала от одной избыточной капли тиосульфата. Замерить и записать объем затраченного на титрование раствора тиосульфата натрия. Повторить титрование еще 2 раза.
Задачи для самостоятельного решения.
Пример 1
Для определения содержания формальдегида навеску технического препарата массой 0,2679 г растворили в воде, добавили NаОН и 50,00 мл 0,1004 н раствора I2 (fэ = ½)
НСОН + 3NаОН + I2 = НСООNa + 2NaI + 2Н2О
После подкисления раствора на титрование избытка иода израсходовано 15,20 мл раствора тиосульфата [Т(Na2S2O3)=0,011600]. Вычислить массовую долю (%) формальдегида в препарате.
Решение.
При обратном титровании избытка иода тиосульфатом
n(НСОН) = n(I2) - n(Na2S2О3).
Составляем расчетную формулу
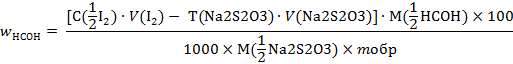
В соответствии с полуреакцией
НСОН + 3ОН- 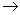 НСОО- + 2Н2О + 2е-
НСОО- + 2Н2О + 2е-
один электрон химически эквивалентен условной частице ½(НСОН), т.е. fэ(НСОН) = ½. Отсюда, молярная масса эквивалента формальдегида равна:
М(1/2НСОН) = 1/2М(НСОН) = 30,0266/2 = 15,0133 г/моль.
Подставляя числовые значения в расчетную формулу, получаем:
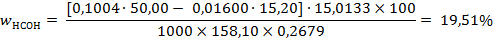
1. Cколько граммов Na2S2O3·5H2O следует взять для приготовления 500мл 0,1Н раствора.
2. Вычислить нормальность раствора I2, если на титрование 0,302г As2O3 израсходовано 40,0мл этого раствора.
3. Навеску 1,45г технического Na2SO3 растворили в колбе на 200мл. На титрование 20мл полученного раствора израсходовали 16,2мл 0,05Н раствора I2. Определить процентное содержание Na2SO3 в навеске.
4. До какого объема следует разбавить 500мл 0,1Н раствор K2Cr2O7 для получения раствора с титром 0,005г/мл?
5. К раствору, содержащему 0,1510г технического сульфита натрия, прилили 100мл 0,0985Н раствора I2, избыток которого оттитровали 48,6мл 0,0204Н раствора Na2S2O3. Вычислить процентное содержание в образце?
Занятие №12
«КОНТРОЛЬНАЯ РАБОТА №2»
Вопросы к контрольной работе №2.
1. Методы разделения и концентрирования в аналитической химии. Классификация методов разделения и концентрирования. Экстракция как частный случай жидкостно-жидкостного распределения, константа и коэффициент распределения. Некоторые основные понятия жидкостной экстракции (экстрагент, экстрагируемое вещество и экстракционный реагент, экстракт).
2. Количественный химический анализ, его задачи и методы. Классификация методов количественного анализа. Определение основных и сопутствующих компонентов. Основные этапы количественного анализа.
3. Титриметрический (объемный) метод анализа. Сущность. Требования к реакциям, лежащим в его основе. Классификация по типу реакций, протекающих между определяемым веществом и титрантом. Основные приемы титрования – прямое, обратное, замещение.
4. Приготовление рабочих растворов с приготовленным и установленным титром. Требования к установочным (стандартным) веществам. Методы отдельных навесок и аликвотных частей (пипетирования). Расчет количества вещества с использованием различных способов выражения концентраций.
5. Кислотно-основное титрование. Рабочие растворы и способы их приготовления. Определение точной концентрации кислот и щелочей. Стандартные вещества и растворы, применяемые в методе кислотно-основного титрования.
6. Кислотно-основные индикаторы, механизм их действия. Интервал перехода окраски кислотно-основных индикаторов. Выбора кислотно-основного индикатора.
7. Расчет, построение и анализ кривых титрования сильных одноосновных кислот сильными основаниями (щелочами). Выбор индикатора.
8. Окислительно-восстановительное титрование; требования к реакциям, лежащим в его основе. Классификация методов окислительно-восстановительного титрования по типу титранта. Определение конечной точки титрования – специфические и редоксиндикаторы, принципы их действия.
9. Перманганатометрия. Общая характеристика метода, его достоинства и недостатки. Рабочий раствор, его приготовление, стандартизация и хранение. Условия титрования и фиксирование конечной точки титрования. Примеры количественных определений. Расчетные формулы.
10. Иодометрия. Общая характеристика метода. Рабочие растворы, приготовление, стандартизация и хранение. Условия титрования - кислотность среды, температура, индикаторы. Расчетные формулы.
11. Броматометрия. Общая характеристика метода, его достоинства и недостатки. Рабочий раствор, его приготовление, стандартизация и хранение. Фиксирование конечной точки титрования. Условия и примеры количественного определения неорганических и органических соединений. Расчетные формулы.
12. Нитритометрия. Общая характеристика метода, его достоинства и недостатки. Рабочий раствор, его приготовление, стандартизация и хранение. Фиксирование конечной точки титрования. Условия и примеры количественного определения неорганических и органических соединений. Расчетные формулы.
13. Цериметрия и дихроматометрия. Общие характеристики методов, их достоинства и недостатки. Рабочие растворы, приготовление, стандартизация и хранение. Фиксирование конечной точки титрования. Условия и примеры количественных определений неорганических и органических соединений. Расчетные формулы.
Занятие №13
«КОМПЛЕКСОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ»
Вопросы к занятию
1. Комплексонометрическое титрование. Титранты метода.
2. Условия комплексонометрического титрования. Способы комплексонометрического титрования.
3. Равновесия в водных растворах ЭДТА. Приготовление стандартного раствора трилона Б
4. Устойчивость комплексонатов металлов в водных растворах
5. Индикаторы комплексонометрического титрования.
6. Кривые комплексонометрического титрования.
7. Применение комплексонометрического титрования.
