Расчет коэффициентов в уравнениях окислительно-восстановительных реакций на основе электронного баланса
Если известны исходные вещества и продукты реакции, то можно рассчитать коэффициенты уравнений, исходя из степеней окисления элементов исходных веществ и продуктов. Отражающие изменение степеней окисления схемы называют уравнениями электронного баланса.
Рассмотрим примеры окислительно-восстановительных реакций, а также последовательность, которой надо придерживаться при составлении соответствующих уравнений реакций.
Пример 1. Обжиг ZnS сопровождается образованием ZnO и SO2:
ZnS + O2 = ZnO + SO2:
 При этом изменяются степени окисления серы и кислорода:
При этом изменяются степени окисления серы и кислорода:
S-2 – 6e = S+4 2
2O + 4e = 2O-2 3
В таких схемах степени окисления условно рассматриваются как заряды атомов.
Схема составлена для двух атомов кислорода, так как молекулы кислорода содержат по два атома; следовательно, число атомов кислорода должно быть четным. Из схемы видно, что для баланса по электронам на две молекулярные единицы ZnS необходимы шесть атомов или три молекулы кислорода. Общее уравнение реакции имеет вид:
2ZnS + 3O2 = 2ZnO + 2SO2
Пример 2.В некоторых случаях окисляемое вещество содержит два восстановителя. Так, при обжиге пирита происходит окисление и железа, и серы:
FeS2 + O2 → Fe2O3 + SO2

 Так как коэффициент будет поставлен перед формулой FeS2, то рассчитывать число отданных электронов надо на всю формулу в целом:
Так как коэффициент будет поставлен перед формулой FeS2, то рассчитывать число отданных электронов надо на всю формулу в целом:
2Fe+2 – 2e = 2Fe+3 -22e 2 *
4S-1 - 20e = 4S+4
 2O + 4e = 2O-2 11
2O + 4e = 2O-2 11
4Fe+2 + 8S-1 + 22O = 4 Fe+3 + 8S+4 + 22O-2
 Степень окисления характеризует атомы соединений. Тем не менее несколько произвольно пользуются и такими схемами:
Степень окисления характеризует атомы соединений. Тем не менее несколько произвольно пользуются и такими схемами:
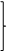 2Fe+2 – 2e = 2Fe+3 -22е 2
2Fe+2 – 2e = 2Fe+3 -22е 2
2S2-2 - 20e = 4S+4 2
 O2 + 4e = 2O-2 11
O2 + 4e = 2O-2 11
4Fe+2 + 4S2-2 + 11O2 = 4Fe+3 + 4S+4 + 22O-2
Окончательное уравнение реакции имеет вид:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Пример 3. При окислении сероводородной кислоты хлором образуется серная и соляная кислоты: H2S + Cl2 = H2SO4 + HCl
Степени окисления изменяют элементы сера и хлор:
 S-2 – 8e = S+6 1
S-2 – 8e = S+6 1
 Cl2 + 2e = 2Cl-1 4
Cl2 + 2e = 2Cl-1 4
S-2 + 4Cl2 = S+6 + 8Cl-1
Поскольку в исходных соединениях кислород не содержится, следует считать, что в окислении сероводородной кислоты хлором участвует вода:
H2S + 4Cl2 + 4Н2О = H2SO4 + 8HCl
Пример 4.При окислении сульфата железа (II) дихроматом калия в сернокислой среде образуются сульфаты железа (III), хрома(III) и калия:
FeSO4 + K2CrO4 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + Н2О
 Степени окисления изменяются у железа и хрома. Электронные оболочки схемы целесообразно составлять сразу на два атома хрома и два атома железа – это обусловлено наличием среди реагирующих веществ Fe2(SO4)3 и Cr2(SO4)3:
Степени окисления изменяются у железа и хрома. Электронные оболочки схемы целесообразно составлять сразу на два атома хрома и два атома железа – это обусловлено наличием среди реагирующих веществ Fe2(SO4)3 и Cr2(SO4)3:
2Fe+2 – 2e = 2Fe+3 3
 2Cr+6 + 6e = 2Cr+3
2Cr+6 + 6e = 2Cr+3
6Fe+2 + 2Cr+6 = 6Fe+3 + 2Cr+3
6FeSO4 + 2K2CrO4 + 8H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + 2K2SO4 + 8Н2О
Коэффициент 2 перед K2SO4 обусловлен коэффициентом 2 перед K2CrO4. Справа от знака равенства 14 сульфат-ионов, поэтому перед H2SO4 ставим коэффициент 8 и далее коэффициент 8 перед Н2О.
В заключение следует отметить, что расставлять коэффициенты в уравнениях с помощью схем электронного баланса можно для окислительно-восстановительных реакций, протекающих между газами, твердыми веществами, расплавами и растворами.
