Вычисление тепловых эффектов. Закон Гесса
Тепловой эффект (изменение энтальпии) реакции при V = const и P = const не зависит от числа промежуточных стадий, от пути процесса и определяется только начальным и конечным состоянием системы.
С DH0 СО2


 DH0=DH01+DH02
DH0=DH01+DH02
DH01 DH02
СО
1. С + О2 ® СО2 DH0 = – 393,5 кДж/моль
2. С + ½ О2 ® СО DH01 = – 110,5 кДж/моль
СО + ½ ® СО2 DH02 = – 283 кДж/моль
 |
– 393,5 = – 110,5 – 283
Следствие из закона Гесса.
Тепловой эффект реакции DH0р равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования реагентов с учетом стехиометрических коэффициентов: DHх0р = SΔН0 (продукты) – SΔН0 (реагенты)
Пример 1. Расчет теплового эффекта реакции по стандартным теплотам образования реагирующих веществ.
Определите количество теплоты, выделяющееся при гашении 100 кг извести водой, если стандартные теплоты образования реагирующих веществ равны (кДж/моль):
∆H0CaO (k) = – 635,1; 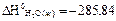 ; ∆H0 Ca(OH)2 (k) = -986.2
; ∆H0 Ca(OH)2 (k) = -986.2
Тепловой эффект реакции по закону Гесса равен:
∆H0х.р. = ∆H0 Ca(OH)2 (k) – [∆H0CaO (k) + ∆H0H2O (ж)]= -986.2-( -635.1 – 285.84)=
=-65.3 кДж
Тепловой эффект реакции рассчитан на 1 моль CaO, то есть на 56 г. Составим пропорцию:
Из 56 г (CaO) выделилось – 65.3 кДж
Из 100000 г (CaO) выдел. - Х кДж
Х = (100000*(-65,3))/56 = -1,16*105 кДж
Ответ: -1,16*105 кДж
Пример2. Вычислить теплоту образования CaCO3 по теплоте реакции разложения CaCO3 на CaO и CO2, равной –200,9 кДж, если известно, что
∆H обр СаО = -635,2 ∆H0 обр СО2 = -393 кДж
Решение. Из уравнения реакции следует
∆H0 обр CaCO3 + ∆H обр СаО + ∆H0 обр СО2 = -200,9 кДж
Отсюда: - ∆H0 обр CaCO3 = -200,9 кДж - ∆H обр СаО - ∆H0 обр СО2
∆H0 обр CaCO3 = -200,9 кДж + ∆H обр СаО + ∆H0 обр СО2 = -200,9 – 635,2 – 393,6 =
=-1229,7 кДж.
Ответ: ∆H0 обр CaCO3 = -1229.7 кДж.
Энтропия.
Энтропияявляется функцией состояния системы ∆S=S2-S1, где S1 и S2 – энтропии начального и конечного состояния системы

Процессы, для которых ∆S>0:
А) расширение газов
Б) фазовые превращения (твердое®жидкое®газообразное состояние)
В) растворение кристаллических веществ
Процессы, для которых ∆S<0:
А) сжижение газов
Б) увеличение концентрации и кристаллизация веществ
Стандартная энтропия чистых веществ относится к 1 моль вещества при Р=101 кПа и Т=298 К и обозначается S2980 [Дж/(К*моль)]
Энергия Гиббса

DGн=DH-TDS
DGн – изменение энергии Гиббса
DH – изменение энтальпии
T – температура, К.
Самопроизвольные химические процессы идут в направлении уменьшения энергии Гиббса: DG<0
DG0 – стандартное изменение энергии Гиббса, когда реакция идет при стандартных условиях (Т=298 К и Р=1.013*103 Па)
DG0=DH0-TDS0
DH0 и DS0 – стандартные изменения энтальпии и энтропии.
Знак G указывает на возможность протекания реакции.
Если DG=0, система находится в состоянии динамического равновесия
Если DG<0, равновесие сдвинуто в сторону образования продуктов реакции.
Если DG>0, равновесие сдвинуто в сторону образования реагентов.
