Регуляция активности ферментов
1. Изменение количества фермента – в результате увеличения или снижения синтеза, например:
· исчезновение пищеварительных ферментов при длительном голодании и их появление в восстановительный период,
· при беременности и родах в молочной железе активируется синтез фермента лактозосинтазы,
· этанол, барбитураты стимулируют синтез «своего» изофермента цитохрома Р450 в печени, который обезвреживает спирт.
Увеличение или снижение синтеза фермента обычно зависит от наличия субстрата и/или количества определенных гормонов.

2. Доступность субстрата (или кофермента), т.е. закон действия масс – увеличение количества одного из субстратов сдвигает равновесие реакции или начинает ее.
Например, для цикла трикарбоновых кислот таким субстратом является щавелевоуксусная кислота (оксалоацетат).
3. Компартментализация – сосредоточение ферментов и их субстратов в одном компартменте (одной органелле) – в эндоплазматическом ретикулуме, митохондриях, лизосомах.
Например, b-окисление жирных кислот протекает в митохондриях, синтез белка – в рибосомах.
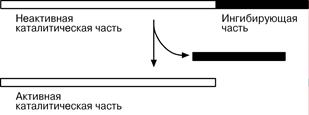 4. Ограниченный протеолиз проферментов – синтез ферментов осуществляется в виде предшественника (трипсиноген, пепсиноген, фибриноген), который при поступлении в нужное место активируется через отщепление от него одного или нескольких пептидных фрагментов.
4. Ограниченный протеолиз проферментов – синтез ферментов осуществляется в виде предшественника (трипсиноген, пепсиноген, фибриноген), который при поступлении в нужное место активируется через отщепление от него одного или нескольких пептидных фрагментов.
Секреция ряда ферментов за пределы клетки в неактивном состоянии позволяет предохранить клетки от повреждения (пищеварительные ферменты) или сохранить белок до наступления определенного момента (фибриноген, белки комплемента).
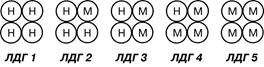 5. Наличие изоферментов. Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента. Различные изоферменты определяют скорость и направление реакции благодаря разному сродству к субстрату.
5. Наличие изоферментов. Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента. Различные изоферменты определяют скорость и направление реакции благодаря разному сродству к субстрату.
Например, существует пять изоферментов лактатдегидрогеназы, фермента, участвующего в обмене глюкозы. Лактатдегидрогеназа-1 (ЛДГ-1) присутствует в миокарде, обладает высоким сродством к молочной кислоте, лактатдегидрогеназа-5 (ЛДГ-5) – находится в печени и скелетных мышцах, обладает низким сродством к лактату. Благодаря этому различию, в скелетных мышцах, несущих ЛДГ-5, часть энергии, особенно в бескислородных условиях, образуется при превращении глюкозы через пируват в лактат. Миокард может использовать для получения энергии молочную кислоту, захватываемую из крови, но только в аэробных условиях.
Дополнение
В отсутствие кислорода пировиноградная кислота накапливается в сердечной мышце, т.к. в воду и углекислый газ превратиться не может и, в тоже время, ЛДГ-1 не позволяет ей существенно превращаться в лактат. В результате токсичный пируват начинает повреждать внутриклеточные структуры и сердечная клетка погибает, развивается инфаркт миокарда. В скелетной мышце при отсутствии кислорода пируват превращается в молочную кислоту, которая быстро покидает миоцит. Мышца, хоть и не в состоянии работать долго в таких условиях, все-таки сохраняет жизнеспособность.
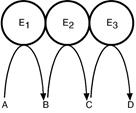 6. Формирование мультиферментных комплексов – комплекс нескольких ферментов (например, Е1, Е2, Е3), осуществляющих ряд последовательных реакций. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.
6. Формирование мультиферментных комплексов – комплекс нескольких ферментов (например, Е1, Е2, Е3), осуществляющих ряд последовательных реакций. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.
Например, пируватдегидрогеназный комплекс, a‑кетоглутаратдегидрогеназный комплекс, комплекс под названиями синтаза жирных кислот или пальмитатсинтаза.
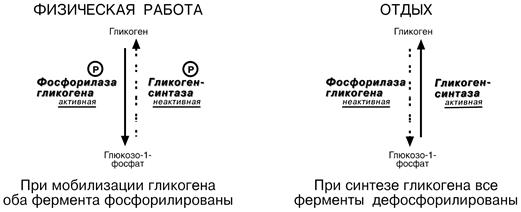
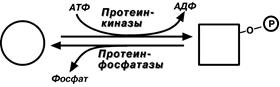 7. Ковалентная (химическая) модификация – обратимое присоединение или отщепление определенной группы, благодаря которому изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина, треонина, тирозина.
7. Ковалентная (химическая) модификация – обратимое присоединение или отщепление определенной группы, благодаря которому изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина, треонина, тирозина.
Ферменты могут быть активны как в фосфорилированном, так и в нефосфорилированном состоянии. Например, гликогенфосфорилаза и гликогенсинтаза.
 |
8. Аллостерическая регуляция
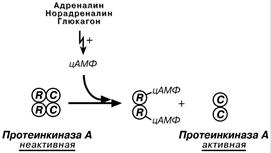 Аллостерические ферменты построены из двух и более субъединиц: часть субъединиц формирует каталитический центр, другая часть является регуляторной. Присоединение эффектора к регуляторной части изменяет конформацию белка и активность каталитической субъединицы. В качестве эффектора обычно выступает продукт данной или последующих реакций, но может быть субстрат реакции или какое-то иное вещество. Например, цАМФ для протеинкиназы.
Аллостерические ферменты построены из двух и более субъединиц: часть субъединиц формирует каталитический центр, другая часть является регуляторной. Присоединение эффектора к регуляторной части изменяет конформацию белка и активность каталитической субъединицы. В качестве эффектора обычно выступает продукт данной или последующих реакций, но может быть субстрат реакции или какое-то иное вещество. Например, цАМФ для протеинкиназы.
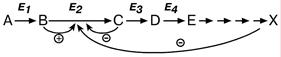 |
Аллостерическими ферментами часто являются ферменты, стоящие в начале метаболических путей и от их активности зависит течение многих последующих реакций.
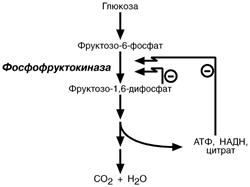 Например, фосфофруктокиназа регулируется НАД, лимонной кислотой, АТФ, фруктозо-1,6-дифосфатом, АДФ, АМФ.
Например, фосфофруктокиназа регулируется НАД, лимонной кислотой, АТФ, фруктозо-1,6-дифосфатом, АДФ, АМФ.
