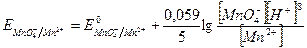Потенциалы. Уравнение Нернста
Способность терять или присоединять электроны различна у различных атомов, ионов или молекул.
Количественной характеристикой способности электронов к переходу от одних атомов или ионов к другим атомам или ионам являются их окислительно-восстановительные потенциалы. Окислительно-восстановительные потенциалы измеряют электрохимически относительно стандартных электродов. Одним из таких стандартных электродов является водородный электрод. Условно принято считать равным нулю нормальный окислительно-восстановительный потенциал водородного электрода 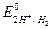 = 0,000 В
= 0,000 В
Нормальными окислительно-восстановительными потенциалами называют потенциалы, измеренные при активности ионов соответствующей пары равной 1 моль/л при температуре 25° С. Их значения приводятся в соответствующих справочниках, некоторые даны в табл. III приложения.
В каждой окислительно-восстановительной паре различают окисленную форму (элемент в более высокой степени окисления, например: Fe3+, Sn4+, Cr2O72-) и восстановленную форму (элемент в более низкой степени окисления – Sn2+, Fe2+, Cr3+). Причём окисленная форма такой пары выполняет роль окислителя, а восстановленная - восстановителя.
Чем меньше величина потенциала, тем активнее восстановитель и тем он сильнее окисляется.
Чем больше положительное значение окислительно-восстановительного потенциала, тем активнее окислитель, и сам он сильнее восстанавливается. Окислители с большим потенциалом способны окислять все восстановители с меньшим потенциалом, и наоборот, восстановители с меньшим потенциалом могут восстанавливать окислители с большим потенциалом.
По величинам нормальных окислительно-восстановительных потенциалов можно судить о возможности, направлении и глубине протекания процесса между различными веществами, осуществить подбор соответствующих окислителей или восстановителей, ответить на вопрос, какие вещества будут реагировать в первую очередь и какие продукты реакции образуются в результате предполагаемого взаимодействия.
Окислительно-восстановительная реакция протекает в том направлении, для которого разность между стандартными потенциалами пары, включающей окислитель, Еокис. и пары, включающей восстановитель, Eвoccт. больше нуля, т.е. ΔЕ > 0.
Из возможных в данных условиях окислительно-восстановительных реакций в первую очередь идет та, которой соответствует наибольшая разность потенциалов, т.е. большая электродвижущая сила процесса (ΔЕ).
Электродвижущая сила, обусловленная данной реакцией, равна разности между значениями потенциала окислителя и потенциала восстановителя: ΔЕ = Еокисл. - Евосст.
Окислительно-восстановительные реакции наиболее активно протекают между сильным окислителем и сильным восстановителем, например, сильный восстановитель - калий и сильный окислитель Cl2 активно реагируют между собой: 2K + Cl2 = 2KCl
Разность потенциалов такой реакции достаточно велика: 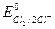 = + 1,36 В;
= + 1,36 В; 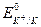 = - 2,92 B; ΔЕ = + 1,36 - (-2,92) = + 4,28 В; ΔЕ >> 0.
= - 2,92 B; ΔЕ = + 1,36 - (-2,92) = + 4,28 В; ΔЕ >> 0.
Из практики известно, что окислительно-восстановительные реакции протекают в заметной степени, если ΔЕ ≥ +0,1 В; становятся практически необратимыми и протекают до конца в выбранном направлении, если ΔЕ ≥ + 0,4 В.
Величины окислительно-восстановительных потенциалов зависят от многих факторов. Основные из них: концентрация окисленной и восстановленной форм, температура, рН среды.
Уравнение Нернста позволяет вычислять значения окислительно-восстановительных потенциалов для конкретных условий:
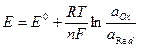 (VII.1)
(VII.1)
где E° - нормальный ред-окс потенциал данной пары; R - универсальная газовая постоянная, 8,314 Дж/град×моль; Т - абсолютная температура; F - число Фарадея, 96500 Кл; n - число отданных или присоединённых электронов; aOx, aRed - активности, соответственно окисленной и восстановленной форм.
При вычислении окислительно-восстановительных потенциалов вместо активностей ионов допускается использование их концентраций.
При температуре 25 °С и замене натурального логарифма на десятичный уравнение Нернста запишется:
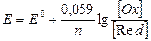 (VII.2)
(VII.2)
Для пары металл - соль данного металла (например, Fе0 - Fe2+) уравнение (VII.2) запишется:
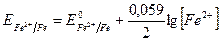
Если в уравнении реакции перехода окисленной формы в восстановленную есть коэффициенты, то они входят в уравнение Нернста в качестве показателей степени для соответствующих активностей (концентраций). Например, для пары Cl2/2Cl-:
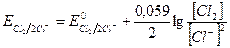
Рассмотрим на примере зависимость величины окислительно-восстановительного потенциала от отношения концентраций окисленной и восстановленной форм. Если [Fe3+] = 0,1 моль/л, a [Fe2+] = 0,01 моль/л, то
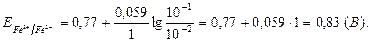
Если в окислительно-восстановительной реакции принимают участие ионы водорода, то значение окислительно-восстановительного потенциала зависит и от концентрации ионов водорода. Например, для реакции восстановления ионов МnО4- до Mn2+ в кислой среде: МnО4- + 5ē + 8H+ = Mn2+ + 4H2O