Опыт № 1.Зависимость от концентрации
В пять пробирок наливают из бюреток 0.1М Na2SO3 и воду в количествах, указанных в таблице. В другие пять пробирок наливают из бюретки по 5 мл 1М H2SO4 (первый раствор приливают ко второму) и отсчитывают время до начала помутнения содержимого каждой пробирки. Результаты записывают в таблицу по форме:
| Объем, мл | C Na2S2O3 а + б + в, моль/л | Время до появления мути, τ, с | Wусл.=1 ∕ τ, 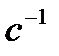 | ||
| Na2S2O3 (а) | H2O (б) | H2SO4 (в) | |||
| 0,01 | |||||
| 0,02 | |||||
| 0,03 | |||||
| 0,04 | |||||
| 0,05 |
В этом и следующих опытах измеряется не скорость реакции, а промежуток времени между началом реакции и ее видимым результатом, однако этот промежуток времени обычно пропорционален скорости реакции, поэтому величину назовем условной скоростью реакции W (усл.). Строят график зависимости скорости разложения тиосульфата от концентрации. Какой вывод можно сделать о порядке исследуемой реакции на основании полученной зависимости?
Опыт №2. Зависимость от температуры
В три пробирки наливают по 5мл 0,1М Na2S2O3, а в три другие. Помещают все пробирки в стакан с водой и через 5 – 7 мин., измерив температуру воды в стакане, сливают вместе содержимое одной пары пробирок с H2SO4 и Na2S2O3 , и отсчитывают время до начала помутнения. Переливают в стакан немного горячей воды так, чтобы температура воды в стакане увеличилась примерно на 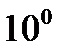 . Слив содержимое второй пары пробирок с H2SO4 и Na2S2O3 , определяют также время до начала появления мути. Опыт с последней парой пробирок проводят при температуре приблизительно на
. Слив содержимое второй пары пробирок с H2SO4 и Na2S2O3 , определяют также время до начала появления мути. Опыт с последней парой пробирок проводят при температуре приблизительно на 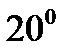 выше первоначальной.
выше первоначальной.
Результаты записывают в таблицу по форме:
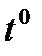 ,С ,С | 1/Т | Время от начала отсчета времени до помутнения, с | Wусл.=1 ∕ τ , 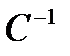 | lg W |
Строят график зависимости логарифма скорости реакции обратной величины абсолютной температуры. Из графика определяют тангенс угла наклона и вычисляют энергию активации: Е=-2,3 tg α
Опыт №3. Зависимость от концентрации катализатора.
В три пробирки наливают по 2 мл 0,1М Na2S2O3 и добавляют по 1, 2, 3мл 0,05М CuSO4 . Кроме того, в первые две пробирки добавляют 2 и 1 мл воды, чтобы общий объем раствора во всех пробирках составлял 5 мл. В другие три пробирки наливают по 5 мл 1М Na2S2O3. Смешивают попарно растворы тиосульфата натрия и серной кислоты и определяют время до помутнения растворов.
Результаты опытов записывают в таблицу по форме:
| C (СuSO4), г-ион/л | Время до начала отсчета. до помутнения, τ, с | Wусл.=1/ τ, 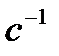 |
Строят график зависимости скорости реакции от концентрации ионов катализатора.
Работа №2.Исследование скорости гидролиза мочевины.
Цель работы.
Получить экспериментальную зависимость скорости гидролиза мочевины от времени в присутствии фермента уреазы и научиться определять скорость реакции по графику.
Водная суспензия соевой муки или арбузных семечек содержит фермент уреазу. Уреаза катализирует гидролиз мочевины по схеме:
H2N-CO-NH2 + H2O 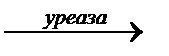 2NH3 + CO2
2NH3 + CO2
Скорость данной химической реакции можно определить по образованию выделяющегося аммиака.
Определение аммиака можно осуществлять различными методами: титрометрическим, электрометрическим, колориметрическим.
