Косвенные потенциометрические методы
Чаще всего потенциометрические измерения используют для определения точки эквивалентности в титриметрическом анализе – потенциометрическое титрование. В ациди- или алкалиметрии в качестве индикаторного электрода применяют стеклянный электрод , т.к. его потенциал зависит от рН среды. В оксидиметрическом титровании применяют редокс – электрод. В осадительном и комплексиметрическом – ионоселективные электроды.
Для определения точки эквивалентности строят кривую титрования (рис.12) – график зависимости ЭДС измерительной цепи от объёма прилитого титранта.
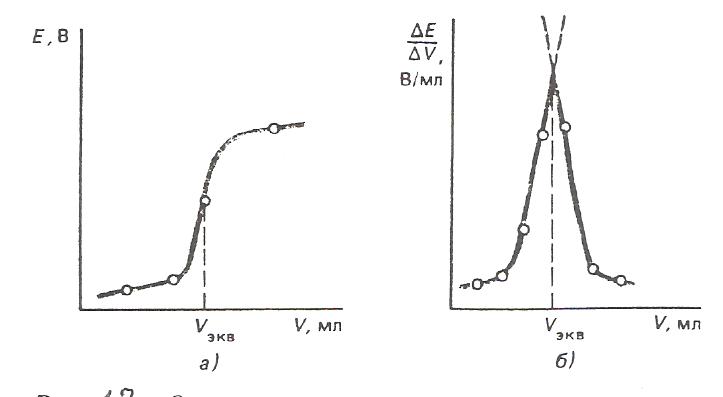
Рис. 12. Определение точки эквивалентности в потенциометрическом титровании: а) по графику  ; б) по графику
; б) по графику 
Затем проецируют точку перегиба кривой титрования на ось абсцисс (рис.12,а). Более точно искомое значение можно определить по графику изменения приращения потенциала на единицу, добавляемого объёма титранта ∆φ/ΔV в зависимости от общего объёма прилитого титранта (рис 12,б).
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ И ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ.
Задача№1:
Рассчитать потенциал кадмиевого электрода, опущенного в водный раствор сульфата кадмия с активностью ионов кадмия 0,015, при температуре 30ºС.
Решение:
Электродная реакция может быть записана следующим образом:
Cd2+ +2ē → Cd
Количество электронов, участвующих в данной электродной реакции n = 2
Равновесный электродный потенциал рассчитываем по уравнению Нернста:
RT
φ = φº+ · ln(aCd2+),
zF
φ = -0,403+(8,314·303/2·96485)ln 0,015 = - 0,4578 B
Задание №1:
Рассчитайте потенциалы электродов при следующих условиях. Средние коэффициенты активности взять из справочника.
| №№ | электрод | условия | №№ | электрод | условия |
| 1-1 | Cu2+/Cu | m=0,1, t = 35ºC | 1-6 | Ni2+/Ni | m=0,05, t = 30ºC |
| 1-2 | Cu2+/Cu | m=1, t = 30ºC | 1-7 | Cd2+/Cd | m=0,1, t =25ºC |
| 1-3 | Zn2+/Zn | m=0,01, t =20ºC | 1-8 | Cd2+/Cd | m= 1,t=32ºC |
| 1-4 | Zn2+/Zn | m=0,1, t =28ºC | 1-9 | Ag+/Ag | m=0,1, t =25ºC |
| 1-5 | Ni2+/Ni | m= 1, t =25ºC | 1-10 | Ag+/Ag | m=0,01, t = 30ºC |
Задача№2
Рассчитать ЭДС гальванического элемента, составленного из полуэлементов Zn2+/Zn и Cu2+/Cu при температуре 20ºС,если активности ионов цинка и меди равны 0,1 и 0,05 соответственно.
Решение.
Zn2++ 2ē → Zn φº Zn2+/Zn = -0,763В,
Cu2+ + 2ē → Cu φº Cu2+/Cu = 0,337В.
Уравнение окислительно-восстановительной реакции записывается следующим образом:
Cu2+ + Zn → Cu + Zn2+,
следовательно, ЭДС гальванического элемента может быть рассчитана на основе уравнения Нернста по формуле:
RT
Е =Еº + ln(aCu2+/aZn2+),
zF
Где Еº = φº Cu2+/Cu - φº Zn2+/Zn = 0,337 –(- 0,763) = 1,1В,
z = 2
Т = 293К
Е = 1,1 + (8,314·293/2·96500)ln(0,05/0,1) = 1,0913В
Задание №2
Рассчитайте ЭДС гальванического элемента при следующих условиях:
| №№ | Электрод1 | а1 | Электрод2 | а2 | Т0С |
| 2-1 | Cu2+/Cu | 0,1 | Cd2+/Cd | 0,15 | |
| 2-2 | Zn2+/Zn | 0,01 | Cu2+/Cu | 0,1 | |
| 2-3 | Ni2+/Ni | Cu2+/Cu | 0,01 | ||
| 2-4 | Ag2+/Ag | 0,1 | Zn2+/Zn | ||
| 2-5 | Cu2+/Cu | 0,1 | Cu2+/Cu | 0,01 | |
| 2-6 | Zn2+/Zn | Zn2+/Zn | 0,15 | ||
| 2-7 | Cd2+/Cd | 0,1 | Cd2+/Cd |
Задача №3:
Как должен быть составлен гальванический элемент, чтобы в нёмпротекала следующая химическая реакция:
2Ag + Hg2Cl2 = 2AgCl + 2Hg.
Чему равна стандартная ЭДС элемента?
Решение.
При работе гальванического элемента серебро окисляется, а ртуть восстанавливается:
Ag – ē → Ag+
Hg22+ + 2ē → 2Hg
Следовательно, хлорсеребряный электрод – отрицательный, а каломельный – положительный. Гальванический элемент можно записать следующим образом:
Ag/AgCl,KCl//KCl,Hg2Cl2/Hg.
Стандартные потенциалы электродных реакций:
φ0Ag+/Ag = 0,222B
φ0Hg22+/Hg = 0,268B.
Стандартная ЭДС гальванического элемента:
Е0 = 0,268 – 0,222 = 0,046В
Задание 3.
Составьте гальванический элемент, чтобы в нём протекали следующие реакции и рассчитайте его ЭДС в стандартных условиях.
| №№ | реакция | №№ | реакция |
| 3-1 | Mn + NiCl2 →MnCl2 + Ni | 3-5 | CuCl2 + H2→ Cu + 2HCl |
| 3-2 | Pb + CuSO4 → PbSO4 + Cu | 3-6 | Zn +H2SO4→ ZnSO4 + H2 |
| 3-3 | Zn + CdSO4→ Cd + ZnSO4 | 3-7 | Cd + CuCl2→CdCl2 + Cu |
| 3-4 | Zn + CuSO4→ Cu + ZnSO4 | 3-8 | Cu+AgNO3→Cu(NO3)2+Ag |
Задача №4
Написать химическую реакцию, протекающую в данном гальваническом элементе в стандартных условиях:
Pt/H+,MnO4- ,Mn2+ //Co3+,Co2+ /Pt.
Решение:
В таблице стандартных потенциалов находим потенциалы электродных реакций:
MnO4- +8H+ + 5ē → Mn2+ +4H2O φ° = 1,51B,
Co3+ + ē → Co2+ φ° = 1,81B.
Следовательно на левом электроде будет происходить окисление Mn2+, а на правом – восстановление Co3+ .
Тогда протекающая в элементе реакция запишется следующим образом:
5 Co3+ + Mn2+ +4H2O = 5Co2+ +8H+ + MnO4-
Задание 4.
Написать химическую реакцию, протекающую в указанном гальваническом элементе и рассчитать его ЭДС в стандартных условиях.
| № | Гальванический элемент | № | |
| 4-1 | Cd/CdSO4//H+/H2,Pt | 4-5 | Mn/MnSO4//CoCl2/Co |
| 4-2 | Pt,H2/HCl//CuCl2/Cu | 4-6 | Zn/ZnSO4//H+/H2,Pt |
| 4-3 | Zn/ZnSO4//KCl/AgCl/Ag | 4-7 | Ag/AgCl,HCl//CuSO4/Cu |
| 4-4 | Ni/NiCl2//AgNO3/Ag | 4-8 | Ni/NiSO4//HCl,AgCl/Ag |
Задача 5.
Рассчитать активность ионов кобальта, если при температуре 298К ЭДС гальванического элемента
Co/CoSO4//H+/H2,Pt
составляет 0,25В.
Решение:
В гальваническом элементе протекает реакция:
2H+ + Co → H2 +Co2+.
Кобальтовый электрод является отрицательным, а водородный – положительным. Тогда ЭДС гальванического элемента:
E = φ°+ - φ-
φ - = φ°+ - E
φ°+ = 0
φ- = -E
φ(Co2+/Co) = -E = -0,25B
RT
φ(Co2+/Co) = φ°(Co2+/Co) + ln(aCo2+)
zF
Решая данное уравнение относительно aCo2+,получаем: aCo2+ = 8,268
Задание№5
Рассчитать активности ионов металла в растворе, если известны потенциалы электродов.
| №№ | электрод | №№ | электрод |
| 5-1 | φ Сd2+/Cd = -0,393B | 5-5 | φ Co2+/Co = -0,215B |
| 5-2 | φ Zn2+/Zn = -0,706B | 5-6 | φ Fe2+/Fe= -0,384B |
| 5-3 | φ Zn2+/Zn = -0,356B | 5-7 | φ Pb2+/Pb= -0,113B |
| 5-4 | φNi2+/Ni = -0,220B | 5-8 | φ Ag+/Ag = 0,810B |
Задача 6:
Рассчитать произведение растворимости хлорида меди при Т = 298 К, если стандартный потенциал электрода Cl-/CuCl/Cu φ0Cl-/CuCl/Cu = 0,137В, а стандартный потенциал медного электрода φ0Cu2+/Cu =0,521 В.
Решение:
На электроде протекает реакция:
CuCl + ē → Cu + Cl-
Стандартный потенциал электрода второго рода:
RT
φ = φ0 Cu+/Cu + ln(aCu2+)
zF
ПР = aCu+ · aCl-, aCu+ = ПР/ aCl-,
RT RT
φ = φ0 Cu+/Cu + ln·ПР - ·ln(aCl-),
zF zF
или
RT
φ = φ0Сl-/CuCl/Cu - ·ln(aCl-),
zF
RT
φ0Сl-/CuCl/Cu = φ0Сu+/Cu + ·lnПР.
zF
Из последнего соотношения выражаем значение ПР и подставляем числовые значения:
lnПР = -14,94,
ПР = 3,19 · 10-7
Задание 6.
Рассчитать ПР соединений, если известны потенциалы электродов второго рода.
| №№ | соединение | электрод | φ0, В |
| 6-1 | AgCl | Cl-/AgCl/Ag | 0,222 |
| 6-2 | PbSO4 | SO42-/PbSO4/Pb | -0,351 |
| 6-3 | Hg2SO4 | SO42-/Hg2SO4/Hg | 0,615 |
| 6-4 | CuCl | Cl-/CuCl/Cu | 0,153 |
| 6-5 | Hg2Cl2 | Cl-/Hg2Cl2/Hg | 0,268 |
| 6-6 | PbI2 | I-/PbI2/Pb | -0,365 |
| 6-7 | ZnS | S2-/ZnS/Zn | -1,405 |
| 6-8 | Ni(OH)2 | OH-/Ni(OH)2/Ni | -0,720 |
Приложение
Таблица 1
Стандартные электродные потенциалы в водных растворах при 250С
| № п/п | электрод | реакция | φ0,В |
| Электроды, обратимые относительно катиона | |||
| H+,H | H+ + ē = H | -2,106 | |
| Al3+,Al | Al3+ + 3ē = Al | -1,662 | |
| Zn2+,Zn | Zn2+ + 2ē = Zn | -0,763 | |
| Fe2+,Fe | Fe2+ + 2ē = Fe | -0,440 | |
| Cd2+,Cd | Cd2+ + 2ē = Cd | -0,403 | |
| Ni2+,Ni | Ni2+ + 2ē = Ni | -0,250 | |
| Sn2+,Sn | Sn2+ + 2ē = Ni | -0,136 | |
| Pb2+,Pb | Pb2+ + 2ē = Pb | -0,126 | |
| Fe3+,Fe | Fe3+ + 3ē = Fe | -0,036 | |
| H+,H2 | H+ + ē = ½H2 | 0,000 | |
| Cu2+,Cu | Cu2+ + 2ē = Cu | 0,337 | |
| Cu+,Cu | Cu+ + ē = Cu | 0,521 | |
| Ag+,Ag | Ag+ + ē = Ag | 0,799 | |
| Hg22+,Hg | ½ Hg22+ + ē = Hg | 0,798 | |
| Электроды, обратимые относительно аниона | |||
| O2, OH- | 1/2O2 + H2O + 2ē = 2OH- | 0,401 | |
| Br2(ж),Br - | 1/2Br2 + ē = Br- | 1,065 | |
| Cl2(г ) ,Cl | 1/2Cl2 + ē = Cl- | 1,360 | |
| Электроды второго рода | |||
| Al, Al(OH)3, OH- | Al(OH)3 +3ē = Al + 3OH- | -2,30 | |
| Zn, Zn(OH)2, OH- | Zn(OH)2+ 2ē = Zn + 2OH- | -1,245 | |
| Cd, Cd(OH)2, OH- | Cd(OH)2+ 2ē =Cd + 2OH- | -0,809 | |
| Ag, AgCl, Cl- | AgCl + ē= Ag + Cl- | 0,222 | |
| Hg, Hg2Cl2, Cl- | 1/2Hg2Cl2 + ē = Hg + Cl- | 0,268 | |
| Ag, Ag2SO4, SO42- | Ag2SO4 + 2ē = Ag + SO42- | 0,654 | |
| Pb, PbSO4, SO42- | PbSO4 + 2ē = Pb + SO42- | -0,359 |
