Скоростью химической реакции называется ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени
Скорость химической реакции. Кинетическое уравнение и константа скорости. Закон действующих масс.
Многое удается узнать о химических реакциях, изучая скорость их протекания и факторы, от которых она зависит. Этим занимается раздел химии, называемый ХИМИЧЕСКОЙ КИНЕТИКОЙ.
Вспомним уже известное нам определение скорости химической реакции:
Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Количество вещества выражают в МОЛЯХ, а объем в ЛИТРАХ. В этом случае мы получаем удобную для работы величину - КОНЦЕНТРАЦИЮ вещества в моль/л, которая ИЗМЕНЯЕТСЯ в ходе реакции.
Таким образом, скоростью реакции называют изменение концентрации какого-нибудь вещества, участвующего в реакции, за единицу времени (например, за секунду или за минуту). Отсюда другое определение скорости реакции:
Скоростью химической реакции называется ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени.
Разницу между тем, что было и тем, что стало, часто обозначают буквой греческого алфавита Δ (дельта) Следовательно, только что приведенное определение математически можно выразить так:
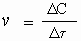
где v - скорость реакции, ΔC - изменение концентрации (в моль/л), а Δτ - интервал времени, в течение которого это изменение произошло (сек). Следовательно, размерность у скорости реакции такая: "моль/л · сек".
За скоростью реакции А + Б = В можно следить по расходованию одного из реагентов (А или Б), либо по накоплению продукта (В). Здесь мы сталкиваемся с серьезной проблемой: скорость реакции может постоянно МЕНЯТЬСЯ. Действительно, в начале реакции, когда молекул А и Б еще много, столкновения между ними происходят гораздо чаще, чем в конце реакции, когда молекул А и Б уже намного меньше. Как мы знаем, столкновения молекул являются поводом для реакции между ними. На рис. 9-10 показана упрощенная модель реакции А + Б = В, в которой каждое столкновение приводит к химической реакции между двумя частицами. Впрочем, такие реакции тоже есть. Например, практически каждое столкновение ионов Н+ и ОН- в растворе приводит к образованию молекулы Н2О (у этой реакции низкая энергия активации).
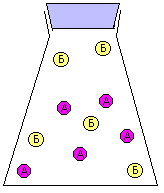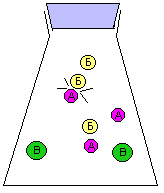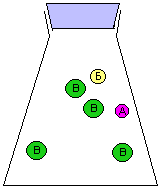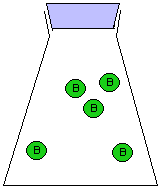
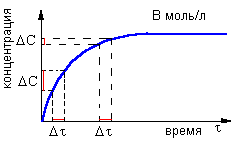
Рис. 9-10. Модель реакции А + Б = В. Образование продукта (В) происходит быстро в начале реакции и замедляется ближе к концу реакции. На графике накопления продукта (В) в смеси хорошо видно, что при одном и том же интервале времени Δt изменение концентрации ΔC в начале реакции больше, чем в конце реакции. Таким образом, скорость химического превращения может постоянно меняться в ходе реакции.
Как же быть в таком случае? Что принимать за истинную скорость реакции? К счастью, существует подход, который позволяет устранить эту трудность в изучении скоростей химических реакций.
Чем больше концентрация молекул (А) или (Б) в смеси, тем больше вероятность столкновения между ними. Если обозначить буквами А и Б (в квадратных скобках) молярные концентрации этих веществ, то скорость реакции будет пропорциональна произведению этих молярных концентраций:
v = [А моль/л][Б моль/л] (1)
В дальнейшем обозначения "моль/л" в квадратных скобках мы уже писать не будем. Заметим, что в полученном нами выражении (1) для скорости химической реакции размерности левой и правой части не совпадают. Действительно, размерность скорости реакции, как мы уже знаем, "моль/л · сек", а размерность произведения в правой части уравнения другая: "моль2/л2". Для того чтобы выровнять размерности в правой и левой частях уравнения, нужен коэффициент пропорциональности. Обозначим его буквой k и присвоим ему размерность "л/моль · сек". Тогда уравнение (1) примет такой вид:
v = k[А][Б] (2)
Оказалось, что коэффициент пропорциональности k способен выполнять гораздо более полезную функцию, чем простое выравнивание размерностей в левой и правой частях уравнения (2). Коэффициент k НЕ ЗАВИСИТ от концентраций [А] и [Б]. Эти концентрации (как и скорость) могут изменяться в ходе реакции, но значение k сохраняется ПОСТОЯННЫМ для данной реакции в выбранных условиях. Поэтому коэффициент k называют КОНСТАНТОЙ СКОРОСТИ РЕАКЦИИ. Уравнение (2) называется КИНЕТИЧЕСКИМ УРАВНЕНИЕМ для реакций типа А + Б = В (или А + Б = В + Г + ...).
Интересно, что в кинетическом уравнении скорость реакции не зависит от количества ПРОДУКТОВ реакции и их концентраций. Это и понятно: ведь скорость реакции в данном случае определяется только столкновениями молекул реагентов (А) и (Б).
Константу скорости k можно определить экспериментально: она численно равна скорости реакции в тот момент, когда концентрации исходных веществ равны 1 моль/л:
v = k[А][Б] = k[1][1], следовательно, в этот момент v = k.
Константа скорости k дает химикам возможность КОЛИЧЕСТВЕННО обсуждать вопросы, связанные с изучением скоростей реакций. Приведем примеры:
| Реакция | Условия | Кинетическое уравнение | k |
| H+ + OH- = H2O | 20 oC | v = k[H+][OH-] | 1,4.1011 л/моль.сек |
| NH4+ = NH3 + H+ | 20 oC | v = k[NH4+] | 24 сек-1 |
Измеренные константы скоростей приведенных реакций позволяют уже не просто говорить о том, что реакция нейтрализации (H+ + OH-) протекает намного быстрее реакции разложения иона аммония. Можно рассуждать количественно: при 20 оС реакция нейтрализации протекает в 6.109 раз быстрее, чем реакция распада иона аммония на аммиак и ион водорода.
** Интересен вопрос о том, почему в кинетическом уравнении (2) фигурирует именно ПРОИЗВЕДЕНИЕ молярных концентраций реагентов? Почему, например, не сумма? Ответ можно получить экспериментально и теоретически. Эксперимент подтверждает правильность кинетического уравнения, но к нему можно прийти и из теории вероятностей.
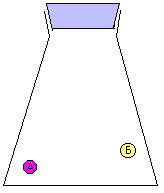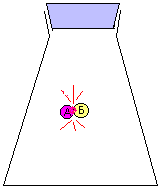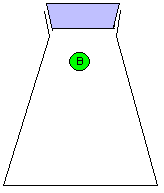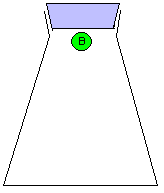 Для того чтобы столкнуться, молекулы (А) и (Б) должны оказаться одновременно в какой-то точке пространства. Вероятность того, что два независимых события произойдут одновременно (молекулы А и Б окажутся в одно время в одном и том же месте) равна ПРОИЗВЕДЕНИЮ вероятностей каждого из этих событий по отдельности. Это положение теории вероятностей легко проверяется. Наибольшую вероятность обозначают единицей. Например, вероятность того, что подброшенная вверх монета упадет плашмя, практически равна 1. Вероятность того, что монета упадет орлом вверх, равна 1/2. Если мы подбросим одновременно две монеты, то вероятность того, что обе они упадут орлом вверх, составляет 1/2 · 1/2 = 1/4. Это означает, что в серии из 4-х опытов с подбрасыванием монет только один раз выпадут два орла. Если в маленькой серии опытов и произойдет отклонение от теории, то в большой серии (например, из 100 опытов), таких отклонений уже практически не наблюдается. Можете проверить сами.
Для того чтобы столкнуться, молекулы (А) и (Б) должны оказаться одновременно в какой-то точке пространства. Вероятность того, что два независимых события произойдут одновременно (молекулы А и Б окажутся в одно время в одном и том же месте) равна ПРОИЗВЕДЕНИЮ вероятностей каждого из этих событий по отдельности. Это положение теории вероятностей легко проверяется. Наибольшую вероятность обозначают единицей. Например, вероятность того, что подброшенная вверх монета упадет плашмя, практически равна 1. Вероятность того, что монета упадет орлом вверх, равна 1/2. Если мы подбросим одновременно две монеты, то вероятность того, что обе они упадут орлом вверх, составляет 1/2 · 1/2 = 1/4. Это означает, что в серии из 4-х опытов с подбрасыванием монет только один раз выпадут два орла. Если в маленькой серии опытов и произойдет отклонение от теории, то в большой серии (например, из 100 опытов), таких отклонений уже практически не наблюдается. Можете проверить сами.
Вероятность для молекул А одновременно оказаться в одном и том же месте прямо пропорциональна молярной концентрации этих молекул [А]. Это же можно сказать о молекулах Б. Следовательно, вероятность их столкновения должна быть пропорциональна ПРОИЗВЕДНИЮ молярных концентраций [А][Б].
Бывают случаи, когда реакция происходит в результате одновременного столкновения трех частиц. Например, для реакции 2А + Б = В (или 2А + Б = В + Г +…) кинетическое уравнение должно выглядеть так:
v = k[А][А][Б] или v = k[А]2[Б]
В общем случае, для реакции
aA +bB + cC = dD + eE + fF + …
кинетическое уравнение для скорости реакции записывается следующим образом:
v = k[A]a[B]b[C]c (3)
Оно представляет собой произведение концентраций реагентов, каждая из которых взята в степени, равной числу молей соответствующего вещества в полном уравнении реакции. Это не что иное, как математическая запись ЗАКОНА ДЕЙСТВИЯ МАСС.
Часто встречается и термин ЗАКОН ДЕЙСТВУЮЩИХ МАСС, причем можно использовать любое из этих названий. Закон действующих масс и его математическое выражение - кинетическое уравнение - называют основным законом химической кинетики. Этот закон можно сформулировать так:
