Тема 1.5. Классификация неорганических соединений и их свойства
Типовой пример решения задачи
Пример 1. Какая масса воды образуется при взаимодействии серной кислоты со 100 г 10%-ного раствора гидроксида натрия?
| Последовательность действий | Пример выполнения действий |
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений | Дано: Mр-ра(NаОН)=100г W(NаОН)=10% Найти: m(Н2О)-? |
| 2.Составьте уравнение химической реакции | Решение: 2NаОН + Н2SO4→ Nа2SO4+2Н2О |
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти» | 2NаОН + Н2SO4→ Nа2SO4+2Н2О |
| 4.Найдите массу NаОН в растворе | 100г - 100% Х г - 10% Х= 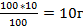 – масса NаОН – масса NаОН |
| 5.Под подчеркнутыми формулами подписать по коэффициентам «моли» | 2NаОН + Н2SO4→ Nа2SO4+2Н2О 2 моль 2 моль |
| 6.Вычислите количество вещества n, которое записано в «Дано». | 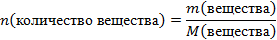 n(NаОН) = n(NаОН) = 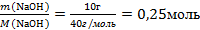 |
| 7.Подпишите найденное n под формулой этого вещества | 2NаОН + Н2SO4→ Nа2SO4+2Н2О 2 моль 2 моль 0,25 моль |
| 8.Под формулой вещества, массу которого надо найти, поставим х моль | 2NаОН + Н2SO4→ Nа2SO4+2Н2О 2 моль 2 моль 0,25 моль х моль |
| 9.Из полученной пропорции выразить х | 2 моль 2 моль 0,25 моль х моль х = 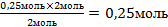 – это количество вещества n(Н2О) – это количество вещества n(Н2О) |
| 10.Зная n(Н2О) найдите массу Н2О | m=nM m (Н2О)= n (Н2О)  M (Н2О) M (Н2О) =1 M (Н2О) M (Н2О) =1  2+16=18г/моль m(Н2О)=0,25 2+16=18г/моль m(Н2О)=0,25 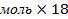 г/моль=4,5г г/моль=4,5г |
| 11.Запишите ответ | Ответ: m(Н2О)=4,5г |
Контрольные задания
Подготовьте сообщения
1. Правила разбавления серной кислоты. Использование серной кислоты в промышленности. ( Указание: техника безопасности при разбавлении водой, применение серной кислоты).
2. Едкие щелочи, их использование в промышленности.( Указание: примеры едких щелочей, их применение).
3. Гашеная и негашеная известь, ее применение в строительстве. Гипс и алебастр, гипсование. ( Указание:что это такое, применение?).
4. Понятие о рН раствора. Кислотная, щелочная, нейтральная среды растворов.(Указание: что такое о рН раствора, уровень рН в указанных средах).
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
Задача 1.
1. Какой объем газа (н.у.) выделится, если к раствору карбоната натрия, прилить 400 г азотной кислоты с массовой долей кислоты 20%?
2. Определите массу осадка, которая образуется при сливании 15 г 5%-ного раствора хлорида бария с раствором сульфата бария.
3. Какая масса нитрата цинка образуется при взаимодействии оксида цинка со 100 г 10%-ного раствора азотной кислоты?
4. Слили 40 г 10%-ного раствора серной кислоты с раствором нитрата бария. Рассчитайте массу образовавшегося осадка.
5. Рассчитайте массу сульфата бария, образующегося при взаимодействии
200 г 7%-ного раствора серной кислоты с раствором хлорида бария.
6. Определите массу осадка, которая образуется при сливании хлорида бария с 10г 8%-ного раствора сульфата натрия.
7. Какова масса осадка, образующегося при сливании 200г 20%-ного раствора гидроксида натрия с раствором сульфата меди (II) ?
8. Какой объем газа (н.у) выделится при сливании 150 г 30%-ной соляной кислоты с раствором карбоната калия?
9. К 400 г 5%-ного раствора сульфата железа (II) прилили раствор гидроксида натрия. Вычислите массу образовавшегося осадка.
10. Какая масса соляной кислоты потребуется для полной нейтрализации 60 г 2% раствора гидроксида натрия?
11. Какой объем газа (н.у.) выделится, если к 100 г 20 %- ного раствора карбоната калия, прилить азотную кислоту?
12. К раствору сульфата железа (II) прилили 200 г 3%-ного раствора гидроксида натрия. Вычислите массу образовавшегося осадка.
13. Определите массу соли полученную при взаимодействии 300г 30%-ного раствора азотной кислоты с гидроксидом калия.
14. Определите массу осадка, которая образуется при сливании 20 г 5%-ного раствора хлорида алюминия с раствором гидроксида натрия.
15. Какая масса нитрата магния образуется при взаимодействии оксида магния с 200 г 20%-ного раствора азотной кислоты?
16. Слили 60 г 10%-ного раствора сульфата натрия с раствором нитрата бария. Рассчитайте массу образовавшегося осадка.
17. Какой объем газа (н.у.) выделится, если к раствору карбоната натрия, прилить 300 г серной кислоты с массовой долей кислоты 10% ?
18. Рассчитайте массу сульфата бария, образующегося при взаимодействии
100 г 5%-ного раствора серной кислоты с раствором нитрата бария.
19. Определите массу осадка, которая образуется при сливании хлорида кальция с 20 г 5%-ного раствора карбоната натрия.
20. Какова масса осадка, образующегося при сливании 200г 20%-ного раствора гидроксида бария с раствором хлорида меди (II) ?
21. К 200 г 5%-ного раствора хлорида железа (III) прилили раствор гидроксида натрия. Вычислите массу образовавшегося осадка.
22. Какая масса серной кислоты потребуется для полной нейтрализации 20 г 2% раствора гидроксида калия?
23. Какой объем газа (н.у.) выделится, если к 10 г 2 %- ного раствора карбоната натрия, прилить соляную кислоту?
24. Определите массу соли полученную при взаимодействии азотной кислоты с 300г 30%-ного раствора гидроксида калия.
25. Определите массу осадка, которая образуется при сливании сульфата алюминия с 200 г 5%-ного раствора гидроксида натрия.
26. Какая масса сульфата магния образуется при взаимодействии оксида магния со 100 г 10%-ного раствора серной кислоты?
27. Какая масса соли образуется при сливании 400 г 5%-ного раствора серной кислоты с гидроксидом калия?
28. Какова масса осадка, образующегося при сливании 400г 10%-ного раствора гидроксида натрия с раствором сульфата меди (II) ?
29. 100 г 10 %-ного раствора хлорида натрия реагирует с раствором нитрата серебра. Вычислите массу образовавшегося осадка.
30. Хлорид бария реагирует с 60 г 3% -ным раствором сульфата меди (II). Вычислите массу сульфата бария.
31. Найдите массу осадка, выпадающего при взаимодействии 80 г 15%-ного раствора гидроксида натрия с раствором нитрата меди (II).
32. Слили 80 г 10%-ного раствора серной кислоты с раствором хлорида бария. Рассчитайте массу образовавшегося осадка.
33. Определите массу осадка, которая образуется при сливании нитрата алюминия с 250 г 6%-ного раствора гидроксида натрия.
34. Определите массу осадка, которая образуется при сливании хлорида бария со 100г 18%-ного раствора сульфата калия.
