Механизмы мышечного сокращения
Мышечное сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина. Биохимический цикл мышечного сокращения состоит из пяти стадий:
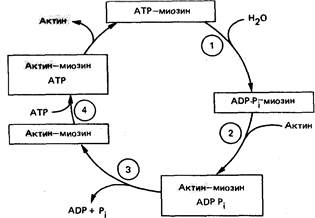
1.Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, при этом АДФ и Фн остаются в составе головки. Миозиновая головка, содержащая АТФ или АДФ и Фн, свободно вращается под большими углами.
2.При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином, образуя актин-миозиновый комплекс, в котором головка миозина располагается к оси фибриллы под углом 90°. Актин значительно ускоряется АТФ-азную активность миозина, в результате весь АТФ гидролизует до АДФ и Фн.
3.У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом головка миозина изменяет свой угол к оси фибриллы
с 90° на примерно 45°, продвигая актин (на 10—15 нм) в направлении центра саркомера.
4.Новая молекула АТФ присоединяется к актин-миозиновому комплексу.
5.Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая головка с АТФ отделяется от F-актина. При этом наступает расслабление. Далее цикл возобновляется.
Вследствие такого движения уменьшается длина каждого саркомера (укорачиваются Н-зона и I-диски) и всей мышцы в целом. При такой системе генерации движения, получившей название системы скользящих нитей, длина филаментов не изменяется. Напряжение, развивающееся при сокращении мышцы, пропорционально степени перекрывают филаментов и, следовательно, числу поперечных мостиков. Эффективность такого сокращения около 50%, а двигателя внутреннего сгорания — менее 20%.
Регуляция сокращения и расслабления мышц
Мышечное сокращение находится под сложным регуляторным влиянием со стороны нервной системы. Мышечное сокращение опосредуется Са2+. Кальциевые насосы постоянно перекачивают Са2+ из саркоплазмы в саркоплазматический ретикулум (у скелетных мышц) или межклеточный матрикс (миокард) (при участии Са-связывающего белка - кальсеквестрина). В результате в саркоплазме покоящейся мышцы концентрация Са2+ составляет всего 10-7-10-8 моль/л. При действии, например,
ацетилхолина на ацетилхолиновые рецепторы происходит возбуждение сарколеммы. Потенциал действия сарколеммы, через Т-систему у скелетных мышц или напрямую у миокарда и гладких мышц, достигает кальциевых каналов саркоплазматического ретикулума (рианодиновые рецепторы). Кальциевые каналы открываются, выпуская Са2+ из саркоплазматического ретикулума в саркоплазму, так что его концентрация в ней возрастает до 10-5 моль/л. Далее механизм регуляции мышечного сокращения в поперечнополосатых и гладких мышцах отличается.
Актиновая регуляция
Актиновая регуляция характерна для поперечнополосатых мышц - скелетных и сердечной.
Мышечное сокращение скелетных мышц ингибирует тропомиозиновая система на 2 стадии сокращения, так как TпI предотвращает присоединение миозиновой головки к соответствующему связывающему сайту F-актина (TпI или изменяет конформацию F-актина или перемещает тропомиозин в то положение, в котором он блокирует сайты связывания миозиновых головок на F-актине). Поступающий в саркоплазму Са2+ присоединяется к тропонину ТnС. Комплекс ТnС•Са2+ реагирует с TnI и ТnТ, влияя на их взаимодействие с тропомиозином. Тропомиозин при этом либо отсоединяется, либо изменяет конформацию F-актина таким образом, что появляется возможность присоединения к нему миозиновой головки тяжелой цепи. Начинается сократительный цикл. Расслабление происходит, когда 1) содержание Са2+ в саркоплазме падает ниже 10-7 моль/л вследствие его поглощения саркоплазматическим ретикулумом; 2) комплекс ТnС•Са2+ утрачивает свой Са2+; 3) тропонин, реагируя с тропомиозином, ингибирует дальнейшее взаимодействие миозиновой головки с F-актином и 4) миозиновые головки в присутствии АТФ отделяются от F-актина, вызывая расслабление.
Так как в сердечной мышце основным источником ионов Са2+ для возбуждения служит внеклеточная жидкость, при отсутствии Са2+ во внеклеточной жидкости сокращения сердечной мышцы прекращаются в течение одной минуты. Скелетная мышца в таких условиях может сокращаться часами.
Исчезновение АТФ из саркоплазмы приводит к следующим последствиям: 1) Са2+-насос саркоплазматического ретикулума перестает поддерживать низкую концентрацию Са2+ в саркоплазме; при этом стимулируется взаимодействие миозиновых головок с F-актином; 2) не происходит зависимого от АТФ отделения миозиновых головок от F-актина, при этом на 5 стадии мышечного сокращения наступает трупное окоченение.
Миозиновая регуляция
Миозиновая регуляция характерна для гладких мышц. У гладких мышц нет тропониновой системы, а легкая цепь (р-цепь) миозина подавляет его АТФ-азную активность и препятствует присоединению миозина к F-актину. В саркоплазме гладких мышц присутствует киназа легких цепей миозина, зависимая от Са2+. При повышении в саркоплазме Са2+, он присоединяется к кальмодулину. Комплекс кальмодулин-4Са2+ активирует киназу легких цепей миозина. Активная киназа легких цепей миозина фосфорилирует легкую цепь р, которая при этом перестает ингибировать АТФ-азную активность миозина и препятствовать взаимодействию миозина с F-актином. В результате начинается сократительный цикл.
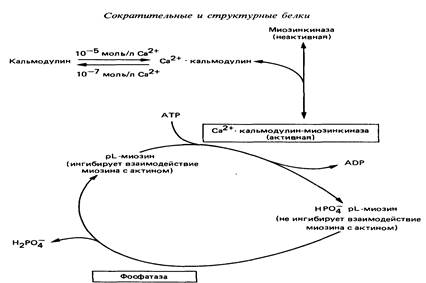
Кальциевая регуляция сокращения гладких мышц (по Р. Марри, 1993).
Расслабление гладких мышц происходит, когда 1) содержание ионов Са2+ в саркоплазме падает ниже 10-7 моль/л; 2) Са2+ отсоединяется от кальмодулина, который в свою очередь отделяется от киназы легкой цепи миозина, вызывая ее инактивацию; 3) нового фосфорилирования легкой цепи р не происходит, и протеинфосфатаза легкой цепи, которая постоянно активна и не зависит от кальция, отщепляет от легкой цепи р ранее присоединившиеся к ней фосфаты; 4) дефосфорилированная легкая цепь р миозина ингибирует связывание миозиновых головок с F-актином и подавляет активность АТФ-азы; 5) миозиновые головки в присутствии ATФ отделяются от F-актина, а повторное их связывание произойти не может из-за присутствия в системе дефосфорилированной легкой цепи р.
