Ионоселективные электроды
Ионоселективные электроды – это электроды, которые состоят из двух фаз: ионита и раствора, а потенциал на границе раздела фаз возникает за счет ионообменного процесса, в результате которого поверхность ионита и раствора приобретают электрические заряды противоположного знака. Иониты обладают повышенной избирательной способностью по отношению к определенному виду ионов, находящихся в растворе, поэтому такие электроды и называют ионоселективными.
Все ионоселективные электроды в зависимости от агрегатного состояния ионита (мембраны) подразделяются на электроды с жидкими и твердыми мембранами.
В качестве жидких мембран используют органические жидкости: хлор – бензол, толуол, которые не смешиваются с водой, не растворяют ионогенное вещество, способное к обмену с ионами данного вида в исследуемом растворе.
К твердым мембранам относятся стеклянные, кристаллические: монокристаллы или прессованные пластинки труднорастворимого соединения и др.
В последнее время область применения ионоселективных электродов расширилась благодаря использованию фермента. Например, мочевина под действием уреазы превращается в ион NH+4. С помощью ионоселективного электрода, содержащего уреазу, можно анализировать раствор на содержание мочевины. В настоящее время используют электроды, содержащие ферменты для определения глюкозы, витаминов, антибиотиков, гормонов, аминокислот и др.
Стеклянный электрод
Стеклянные электроды изготавливают из стекла определенного состава. Стекло чаще всего представляет собой соединение диоксида кремния с щелочными и щелочно–земельными оксидами. В результате гидролиза силикатов на поверхности стекла образуется тонкая пленка геля поликремниевой кислоты, незначительно диссоциированной на ионы.
R–O–Si–OH ↔ R–O–Si–Oˉ+ H+
|| ||
О О
Анионы поликремниевой кислоты R–OSiO2ˉ сообщают отрицательный заряд поверхности стекла. Ионы водорода заряжают положительно прилегающий к поверхности стекла слой раствора. Степень диссоциации поликремниевой кислоты зависит от концентрации ионов водорода в растворе.
Одной из распространенных форм стеклянного электрода является стеклянная трубка, заканчивающаяся шариком (рис. ). Шарик заполнен раствором HCl, в который погружен вспомогательный х.с. электрод. Шарик погружают в исследуемый раствор и с помощью мостика стеклянный электрод соединяют с внешним электродом сравнения. Собранную таким образом цепь можно записать следующим образом:
Ag,AgCl | HCl(p )| стекло | исследуемый раствор || KCl(p) || KCl(p) | AgCl,Ag
внутренний φ2 φ3 φ4 внешний электрод электрод
сравнения φ1 сравнения
ЭДС этой цепи определяется суммой :φ1 + φ2 + φ3 + φ4.
Скачки потенциалов φ1, φ2 и φ4 постоянны, следовательно, ЭДС цепи изменяется в зависимости от потенциала φ3, зависящей от рН исследуемого раствора.
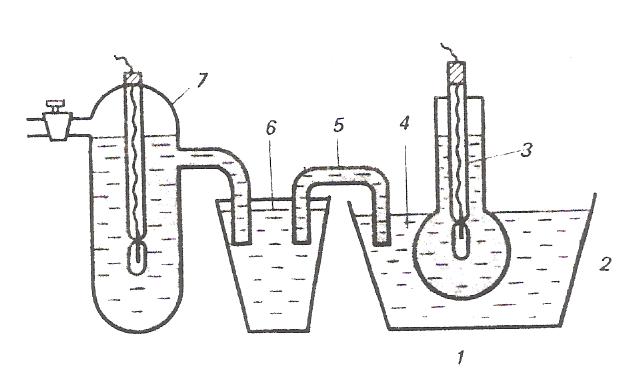
Рис.8. Стеклянный электрод:
Шарик из стеклянной мембраны; 2 – раствор НСl; 3 – внутренний сереброхлоридный электрод; 4 – исследуемый раствор; 5 – агаровый мостик; 6 – раствор хлорида калия; 7 – внешний сереброхлоридный электрод
Электродная реакция сводится к обмену ионами водорода между двумя фазами – раствором и стеклом. В реакцию обмена вовлекаются и ионы щелочных металлов. Устанавливается равновесие
Н+(ст) + М+(р) ↔ Н+(р) + М+( ст)
Условие равновесия этой реакции выражается в законом действующих масс:
ан+(р) · ам+(ст)
Кобм =
ан+(ст) · ам+( р)
Размер этой константы обмена зависит от свойств стекла и температуры.
Исходя из предположения, что в стекле данного сорта сумма активностей ионов водорода и ионов щелочного металла постоянна, т.е.
ан+ (ст) + ам+ (ст) = а,
уравнение константы обмена можно представить в следующем виде:
ан+ (р)(а - ан+ (ст))
Кобм =
ан+ (ст) · ам+ ( р)
Решая это уравнение относительно ан+ (р) / ан+ (ст) , получим
ан+ (р) ан+ (р) + Кобм · ам+ ( р)
=
ан+ (ст) а
Потенциал стеклянного электрода (φ0) может быть выражен следующей зависимостью:
RT ан+ (р)
φст = φ˚ст + · ln
zF ан+ (ст)
Замена ан+ (р)/ан+ (ст) в уравнении электродного потенциала стекла его значением приводит к следующей зависимости:
RT
φст = φ˚ст + ln (ан+ (р) + Кобм · ам+ ( р)),
zF
где RT/zF·ln(a) входит стандартный потенциал стеклянного электрода φ0.
Таким образом, в общем случае потенциал любого стеклянного электрода обусловливается двумя величинами – активностью ионов водорода и активностью щелочного металла. Если в растворе ан+ (р) >> Кобм · ам+ ( р), то
RT RT
φст = φ˚ст + ·ln ан+ (р) = φ˚ст – 2,3 ·pH,
ZF F
т.е. электрод обладает водородной функцией и поэтому может служить индикаторным электродом при определении рН.
Если в растворе ан+ (р) << Кобм · ам+ ( р), то
RT RT
φст = φм = φ˚ст + ·ln Кобм + ·ln ам+ ( р),
ZF zF
RT
илиφм = φ˚м + ·ln ам+ ( р),
zF
во всех уравнениях z=1.
Стеклянный электрод с металлической функцией может использоваться в качестве индикаторного электрода для определения активности соответствующего щелочного металла. Таким образом, в зависимости от сорта стекла, точнее от величины константы обмена, стеклянный электрод может обладать водородной и металлическойфункциями.
ЭЛЕКТРОДЫ ВТОРОГО РОДА.
Электроды второго рода состоят из металла, труднорастворимой соли этого метала и второго соединения, хорошо растворимого и с тем же анионом, что и первое соединение. Условное обозначение таких электродов М׀МА׀А-. Представителями электродов второго рода являются хлорсеребряный и каломельный электроды.
Хлорсеребряный электрод Аg ׀ Ag Cl. KCl
Хлорсеребряный электрод (рис. 9) представляет собой серебряную проволоку, покрытую слоем хлорида серебра и опущенную в сосуд, наполненный насыщенным раствором хлорида калия. Сосуд имеет микрощель для контакта с исследуемым раствором.
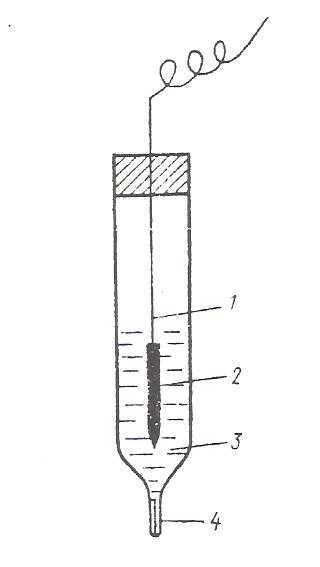
Рис.9. Хлорсеребряный электрод: 1-серебряная проволока; 2-слой AgCl; 3-раствор KCl; 4-микрощель
Основной химический процесс:
Аg+ + ē ↔ Аg◦
Сопровождается реакцией растворения или осаждения соли АgСl:
АgСl ↔ Аg+ + Сl ‾
В присутствии хлорида калия, содержащего одноименный с хлоридом серебра ион хлора, растворимость хлорида серебра снижается. При постоянных концентрации KCl и температуре концентрация ионов Аg+ постоянна, чем и объясняется необходимая устойчивость потенциала электрода.
Потенциал хлорсеребряного электрода возникает на поверхности соприкосновения металлического серебра с раствором его ионов и может быть выражен следующим уравнением:
RT
exc = e°Ag+ ∙ ln a(Ag+)
zF
Хлорид серебра трудно растворим в воде. Его произведение растворимости ПР = a(Ag+)∙a(Сl‾), из которого следует что a(Ag+) = ПР/ a(Сl‾). Подставляя a(Ag+) в уравнение для потенциала хлорсеребряного электрода, получим:
RT RT
φхс = φAg°+ ∙ ln(ПР) – ∙ ln a(Сl‾)
ZF zF
Объединяя постоянные при данной температуре величины e°Ag и RT/zF ∙ ln(ПР) в одну величину и обозначая её через e°xc, получают уравнение для потенциала хлорсеребряного электрода:
RT
φхс = φ°хс – ∙ ln a(Сl‾)
zF
Таким образом, потенциал хлорсеребряного электрода в конечном итоге зависит от концентрации (активности) ионов хлора.
