Экспериментальная часть. лабораторная работа 8.1
Лабораторная работа 8.1. Кондуктометрическое определение
Электрической проводимости растворов слабых электролитов
Цель работы: определение степени и константы диссоциации растворов слабых электролитов различных концентраций.
Реактивы: калий хлористый КС1 концентрации 0,02 и 0,01 моль/л; вода дистиллированная; слабый электролит (по заданию преподавателя).
Оборудование: реохордный мост Р-38, кондуктометрическая ячейка, стакан вместимостью 100 мл, бюретки вместимостью 25 мл, стеклянная палочка, фильтровальная бумага.
Методика работы
Измерение электрической проводимости растворов практически сводится к измерению их сопротивления. В данной работе она определяется с помощью реохордного моста Р-38, работающего на переменном токе.
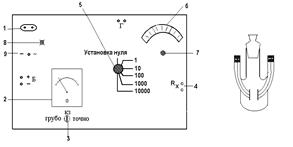
Реохордный мост Р-38 (рис. 8.4) является уравновешенным мостом со ступенчато регулируемым плечом сравнения 5 и плавно регулируемым отношением плеч 6.
а б
Рис. 8.4. Реохордный мост Р-38:
а – схема верхней панели (1 – гнездо для подключения прибора в сеть; 2 – гальванометр; 3 – переключатель гальванометра; 4 – клемма
для подключения измерительного сосуда; 5 – переключатель плеча сравнения; 6 – шкала реохорда; 7 – ручка для регулирования значения отношения плеч реохорда; 8 – индикаторная лампочка;
9 – переключатель питания); б– кондуктометрическая ячейка
Реохордный мост смонтирован в пластмассовом ящике с крышкой, на внутренней стороне которой размещены схема и краткие правила пользования прибором. Питание осуществляется от сети переменного тока с напряжением 127 или 220 В. К мосту прилагается кондуктометрическая ячейка для определения электрической проводности растворов, электроды в ячейках изготавливаются из платины.
Измерение сопротивления растворов с использованием реохордного моста Р-38 проводят в следующем порядке:
1) прибор присоединяют к сети переменного тока с напряжением 220 или 127 В (обратить внимание на включение вилки в гнездо на панели. Знак «¯» вилки должен быть обращен к «220» или «127» В, указанному около гнезда для подключения прибора 1, и соответствовать напряжению в сети переменного тока!), при этом загорается индикаторная лампа 8;
2) переключатель питания 9 ставят в положение «~»;
3) переключатель плеча сравнения 5 переводят в положение «Установка нуля»;
4) установив переключатель гальванометра в положение «точно», вращением корректора устанавливают стрелку гальванометра в нулевое положение;
5) гальванометр выключают, переводя его переключатель в положение «КЗ»;
6) электроды кондуктометрической ячейки подключают к клеммам 4 и приступают к измерению электрической прводимости раствора;
7) переключатель гальванометра переводят в положение «грубо», уравновешивают мост вращением рукояток плеча сравнения 5 и реохорда 7, устанавливая стрелку гальванометра в нулевое положение;
8) переключатель гальванометра переводят в положение «точно» и доуравновешивают мост, затем выключают гальванометр, переводя его переключатель в положение «КЗ»;
9) производят отсчет значений сопротивления умножением показания плеча сравнения 5 (Rср) на показание шкалы реохорда 6 (m):
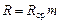 . (8.14)
. (8.14)
Сопротивление раствора измеряют трижды и берут среднее значение.
После окончания измерений на приборе Р-38:
– выключают гальванометр, переводя его переключатель в положение «КЗ»;
– переводят переключатель плеча сравнения в положение «Установка нуля»;
– приводят шкалу реохорда к нулевому делению;
– выключают прибор тумблером переключателя питания 9, а затем из сети переменного тока.
Порядок выполнения работы
1. Определение константы кондуктометрической ячейки
Для измерения электрической проводимости растворов электролитов необходимо знать константу кондуктометрической ячейки (или сосуда). Дело в том, что экспериментально определяемое сопротивление раствора зависит не только от концентрации электролита, площади электродов и расстояния между ними, но и от формы, взаимного расположения, степени погружения и объема раствора, так как в переносе электричества участвует значительно больший объем раствора, чем тот, который заключен между электродами. Поэтому форма и расположение электродов, а также объем растворов должны быть постоянными во всех измерениях.
Если расстояние между электродами кондуктометрической ячейки для измерения электрической проводимости равно l, S – площадям их поверхности, а f – фактору, зависящему от геометрических особенностей ячейки, то измеренное сопротивление раствора составляет
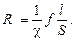 (8.15)
(8.15)
Так как значения f, l, S – постоянны, то можно записать:
χ = Kя/R, (8.16)
где Kя – константа (постоянная) ячейки (сосуда), м–1, является индивидуальной характеристикой каждой кондуктометрической ячейки; Kя = (f l)/S.
Для измерения электрической проводимости растворов используют ячейки (сосуды) либо с прочно закрепленными платиновыми электродами (см. рис. 8.4, б), либо с электродами, погруженными в сосуд на время работы. Площадь электродов, расстояние между ними подбирают в зависимости от значения измеряемого сопротивления. Чем больше сопротивление, то есть меньше удельная электрическая проводимость, тем большую поверхность должны иметь электроды и тем меньше должно быть расстояние между ними.
Для определения константы ячейки измеряют сопротивление стандартных растворов хлорида калия с известной удельной электрической проводимостью в широком диапазоне температур при нескольких концентрациях. В данной работе для этой цели используют водные растворы хлорида калия концентраций 0,01 и 0,02 моль/л. Значения удельных электрических проводимостей этих растворов при различных температурах приведены в прил. 3.
Измеряют сопротивление растворов KCl концентрации 0,01 и 0,02 моль/л, начиная с раствора меньшей концентрации. Перед измерением кондуктометрическую ячейку ополаскивают небольшим объемом раствора хлорида калия концентрации 0,01 моль/л. Затем ячейку заполняют 50 мл раствором хлорида калия концентрации 0,01 моль/л и проводят измерение сопротивления раствора трижды (сбивая показание по шкале реохорда m) и берут среднее значение. Аналогично измеряют сопротивление раствора KCl концентрации 0,02 моль/л. Константу ячейки вычисляют по уравнению
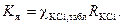 (8.17)
(8.17)
При концентрациях электролита более 0,001 моль/л электрическая проводимость хлорида калия существенно превышает электрическую проводимость воды, поэтому электрической проводимостью воды можно пренебречь. Для дальнейших расчетов берут среднее арифметическое значение константы ячейки.
Результаты измерений и расчетов заносят в табл. 8.1.
Таблица 8.1
Определение константы кондуктометрической ячейки
| СKCl, моль/м3 | RKCl, Ом | ΧКС1, См/м | Kя, м–1 |
Полученное значение константы ячейки можно использовать для расчета удельной электрической проводимости любой жидкости по уравнению (8.17). При этом необходимо следить за тем, чтобы расположение электродов и объем жидкости в ячейке не изменялись. Объем раствора определяется объемом кондуктометрической ячейки, уровень жидкости должен быть выше верхнего края электродов на 5-10 мм.
2.Электрическая проводимость воды
При малых концентрациях растворов учитывают электрическую проводимость самой воды, так как она становится сравнимой с таковой у электролита. Для обычной дистиллированной лабораторной воды из-за свободного растворения в ней СО2 и NН3 и выщелачивания стекла 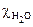 =1×10–4См/м при 25 оС и возрастает с увеличением температуры на 1 оС (вблизи комнатной температуры) на 2–2,5 %.
=1×10–4См/м при 25 оС и возрастает с увеличением температуры на 1 оС (вблизи комнатной температуры) на 2–2,5 %.
Для точного определения c электролита из измеренной удельной электрической проводимости раствора cизм вычитают значение электрической проводимости воды 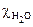 :
:
c = cизм – 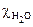 . (8.18)
. (8.18)
3. Исследование электрической проводимости растворов слабых электролитов, определение степени и константы электролитической диссоциации.
Для изучения электрической проводимости исследуемого слабого электролита (по заданию преподавателя) используют исходный раствор концентрации 0,1 моль/л. Затем путем последовательного разбавления исходного раствора в мерной колбе вместимостью 100 мл получают растворы следующих концентраций, моль/л: 0,05; 0,025; 0,01; 0,005; 0,0025; 0,001. Измеряют сопротивление R, начиная с раствора самой низкой концентрации.
Результаты измерений заносят в табл.8.2.
Таблица 8.2
Определение электрической проводимости, степени
и константы диссоциации слабого электролита
| С, моль/м3 | R, Ом | Кя, м–1 | c, См/м | l, 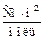 | l¥, 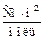 | a | Кс | |
| рассчит. | табличное | |||||||
На основании полученных экспериментальных данных:
1) зная найденное ранее значение константы кондуктометрической ячейки Кя и значение сопротивления R, рассчитать удельную электрическую проводимость c пяти исследуемых растворов по уравнению (8.16), в случае необходимости внести поправку на проводимость воды (8.18);
2) рассчитать эквивалентную электрическую проводимость l исследуемых растворов по уравнению (8.5);
3) построить графики зависимостей: c = f (С), l = f ( 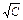 );
);
4) пользуясь значениями предельных подвижностей ионов (прил. 3), по закону независимого движения ионов Кольрауша рассчитать предельную эквивалентную электрическую проводимость электролита;
5) рассчитать степень диссоциации a слабого электролита в каждом исследуемом растворе (8.9);
6) построить график зависимости a от концентрации раствора;
7) сделать вывод о влиянии концентрации на электрическую проводимость;
8) по закону разведения Оствальда (8.10) рассчитать константу диссоциации Кс для каждого раствора и найти ее среднее значение;
9) сравнить найденное значение константы диссоциации с табличными данными (прил. 4);
10) сделать вывод о влиянии концентрации раствора на значения a и Кс;
11) измеренные и рассчитанные значения внести в табл. 8.2, сравнить с литературными данными.
