Измерение электродного потенциала
В настоящее время нет методов по измерению абсолютного значения потенциала отдельного электрода, но может быть определена условная количественная величина электродного потенциала по отношению к какому-либо другому электроду, который выбран в качестве электрода сравнения.
В качестве электрода сравнения был выбран и используется сейчас стандартный водородный электрод.
Такой электрод содержит платиновую фольгу, погруженную в раствор, содержащий ионы водорода и который постоянно омывается газообразным водородом. Газообразный водород имеет давление 1 aтмосфера и активность ионов водорода в растворе равна 1 (, (упрощенно- когда концентрация = 1).
Следующая реакция происходит на водородном электроде:
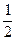 H2 Û H+ + e
H2 Û H+ + e
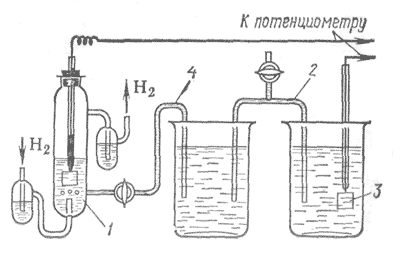
1-раствор, содержащий Н+ -ионы (aH+ =1),
2- электролитический ключ (солевой мостик),
3-электрод, потенциал которого измеряется,
4- электролитический ключ (трубка с раствором электролита)
Электродный потенциал равен ЭДС гальванического элемента, который состоит из данного электрода и стандартного водородного электрода
Если правильно его использовать, водородный электрод может давать очень точные результаты, воспроизводимые до 0.00001В. Но его большая чувствительность (зависимость) к внешним условиям сильно препятствует его использованию, поэтому другой более стабильный электрод с точно известным электродным потенциалом используется в качестве сравнения вместо водородного электрода. Один из таких наиболее распространенных - хлор-серебрянный электрод, который представляет собой серебряную проволочку, покрытую AgCl и погруженную в раствор KCl (чаще всего - насыщенный).
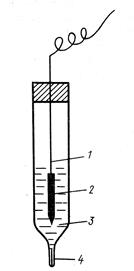
1- серебряная проволочка,
2 - хлорид серебра,
3 - раствор KCl,
4 - электролитический ключ (капилляр, заполненный пористым инертным
веществом, пропитанный раствором KCl)
Гальванический элемент состоит из 2-х частей, каждая из которых содержит один электрод. Меняя одну из частей можно создавать очень разные гальванические элементы.
Электродвижущая сила гальванического элемента (э.д.с.) это максимальное значение разности потенциалов между электродами:
E = jc - ja E всегда ³ 0
гдe jc - потенциал катода,
ja - потенциал анода.
Окисление имеет место на аноде и восстановление - на катоде.
Пример записи гальванического элемента, содержащего Zn электрод в растворе ZnSO4 и Cu электрод в растворе CuSO4:
Zn - 2e ® Zn2+
Cu2+ + 2e ® Cu
следующий:
(-) Zn çZn2+ ççCu2+ çCu (+)
(-) Zn çZnSO4 ççCuSO4 çCu (+)
Zn çZn2+ означает скачок потенциала на границе метал-раствор ионов металла
ZnSO4 ççCuSO4 показывает диффузный скачок электродного потенциала между двумя растворами.
Диффузионным потенциалом называется разность потенциалов, возникающая на поверхности раздела между 2-мя растворами, различающимися или по виду растворенного вещества ли по его концентрации.
Максимальная полезная работа гальванического элемента. При обратимом проведении какой-либо реакции, проходящей при постоянной температуре и давлении получаемая от нее работа будет максимальной работой реакции А'max. Работа, совершаемая гальваническим элементом в этих условиях равна ЭДС элемента умноженная на количество прошедшего электричества. Мы будет выражать количества веществ которые подверглись превращениям в результате реакций в единицах грамм-атомов элемента (или грамм-ионов для комплексных ионов). Количество электричества, которое соответствует такому превращению (гр-ат или гр-ион) будет равным ne×F кулонов,
гдe ne - заряд иона,
F =96487 кулон/мoль (or Кл×мoль-1)- константа (число) Фарадея
(физический смысл числа Фарадея - заряд 1грaмм-атом (или ион) вещества).
A'max = W'max =-DGch.r. =ne×F×E
где W'max - обозначение работы в электрохимии.
Для реакции:
b×B + d×D Û q×Q + r×R
-DG =R×T 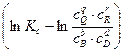

E = - 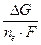 =
= 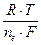
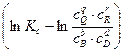 = Eo -
= Eo - 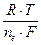 ln
ln 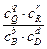
E = Eo - 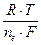 ln
ln 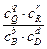 - уравнение Нернста.
- уравнение Нернста.
Eo - ЭДС гальванического элемента в стандартных условиях когда cB = cD= cQ= cR =1
Величина Eo - называется нормальной (или стандартной) ЭДС элемента.
Если взять гальванический элемент со стандартным водородным электродом тогда потенциал металлического электрода равен: j = jo + 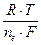 lncM
lncM
гдe jo - стандартный потенциал электрода - то есть потенциал, который возникает когда активность (концентрация) ионов металла равна единице.
Рассчитать электродный потенциал различных металлов в растворах их солей при различных концентрациях можно используя уравнение Нернста и значения стандартных электродных потенциалов этих металлов, которые можно найти в справочниках.
Стандартные электродные потенциалы различных электродов можно расположить в так называемый ряд напряжений - электрохимический ряд активности металлов (ряд стандартных электродных потенциалов) - последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+:
Men+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
В международном союзе ЮПАК (Union Pure and Applied Chemistry) принято, что потенциал металлов, которые по отношению к стандартному водородному электроду является отрицательными, записываются со знаком "минус" перед их значением. Если металл по отношению к стандартному водородному электроду - положителен, то его значение записывается со знаком плюс.
Поляризация
Поляризация - это отклонение потенциалов электрода от его равновесного значения при прохождении электрического тока. Поляризация уменьшает эдс гальванического элемента и скорость электролиза.
Концентрационная поляризация происходит из-за изменения концентрации ионов вблизи поверхности электродов в результате электрохимической реакции:
Zn - 2e ® Zn2+
Cu2+ + 2e ® Cu
Концентрация Zn2+ -ионов возрастает
Dj = jo + 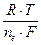 lnc'Zn - (jo +
lnc'Zn - (jo + 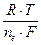 lncZn) =
lncZn) = 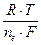 ln
ln 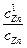
Концентрация Cu2+ -ионов уменьшается
Химическая поляризация происходит из-за изменения состояния (природы) поверхности электрода под действием продуктов электрохимической реакции (образование веществ на поверхности электрода, которые препятствуют электрохимической реакции):
2H+ + 2e ® H2 (покрывает поверхность электрода)
Реакция может изменить металлический электрод на "водородный" (например, медный электрод можно "превратить" в водородный)
Dj = joH2 - joCu = - 0.337 V
Оба типа поляризации могут быть уменьшены различными способами, которые называются деполяризацией.
Концентрационная поляризация может быть значительно уменьшена интенсивным перемешиванием раствора. Химическая поляризация может быть уменьшена добавлением веществ, которые будут реагировать с теми веществами, которые вызвали поляризацию. Например, в качестве деполяризатора для реакции, в результате которой выделяется газообразный водород, можно применить перекись водорода и снизить деполяризацию:
H2 + H2O2 ® 2H2O.
