Примеры решения типовых задач. Пример 1. Вычисление тепловых эффектов химических реакций по значениям теплот
Пример 1. Вычисление тепловых эффектов химических реакций по значениям теплот образования реагентов и продуктов реакции.
Задача 1. Рассчитайте тепловой эффект реакции 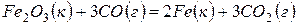 , если значения теплот образования реагентов и продуктов составляют:
, если значения теплот образования реагентов и продуктов составляют:
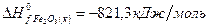
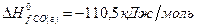
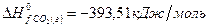
Решение. В соответствии со следствием из закона Гесса
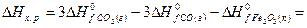
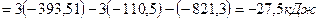
Ответ: 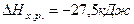 .
.
Пример 2. Вычисление изменения внутренней энергии.
Задача 1. Определите изменение внутренней энергии при испарении 46,8г бензола при 20оС. Теплота испарения бензола при этой температуре составляет 30,92 кДж/моль. Пары бензола подчиняются законам идеальных газов.
Решение. Изменение внутренней энергии и тепловой эффект процесса связаны между собой соотношением
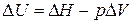 .
.
В соответствии с уравнением Менделеева-Клапейрона: 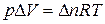 , тогда
, тогда
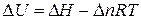 ,
,
где 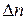 – изменение числа моль газообразных веществ в результате процесса.
– изменение числа моль газообразных веществ в результате процесса.
Для процесса испарения бензола
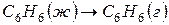
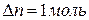 , теплота испарения бензола равна 30,92кДж/моль, то есть,
, теплота испарения бензола равна 30,92кДж/моль, то есть, 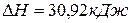 . Тогда изменение внутренней энергии при испарении 1 моль бензола
. Тогда изменение внутренней энергии при испарении 1 моль бензола
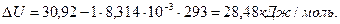 .
.
Число моль бензола составляет
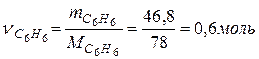 .
.
Тогда изменение внутренней энергии при испарении 48,6г бензола составляет 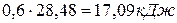 .
.
Пример 3. Определение теплового эффекта реакции на основе тепловых эффектов отдельных стадий процесса.
Задача 1. Даны три уравнения химических реакций:
(1) 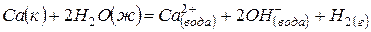 ,
, 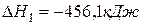
(2) 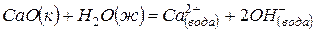 ,
, 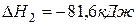
(3) 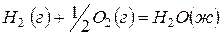 ,
, 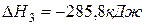 .
.
Определите тепловой эффект реакции 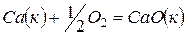 .
.
Решение. Любая сложная химическая реакция может быть представлена как алгебраическая сумма ее отдельных стадий. Нетрудно заметить, что реакция 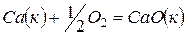 представляет собой результат комбинаций трех стадий (1) – (2) + (3). Тогда
представляет собой результат комбинаций трех стадий (1) – (2) + (3). Тогда
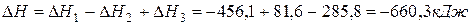 .
.
Пример 4. Расчет тепловых эффектов на основе энергий химических связей. Оценка энергий химических связей на основе теплового эффекта химической реакции с учетом энергии других разрывающихся и образующихся в химической реакции связей.
Задача 1. Рассчитайте энергию химической связи в молекуле HBr, если известны тепловой эффект реакции 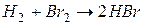 ,
, 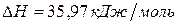
и энергии диссоциации молекул Н2 и Br2 .
Решение. Предположим, что процесс протекает через стадии диссоциации реагентов и образование молекулы HBr. Этот процесс можно представить совокупностью следующих стадий:
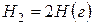 ,
, 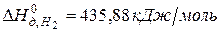
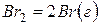 ,
, 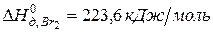
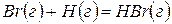 ,
, 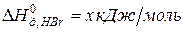
 |
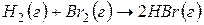 ,
, 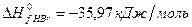
В соответствии с законом Гесса
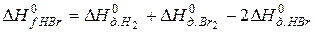
откуда: 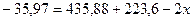
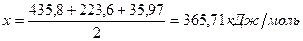
Таким образом, энергия связи HBr 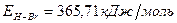 .
.
Пример 5. Определение знака изменения энтропии на основе структуры исходного и конечного состояний системы.
Задача 1. Как изменяется энтропия процесса таяния льда?
Решение. Изменение энтропии этого процесса характеризует величина
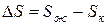
Кристаллическое состояние характеризуется высокой упорядоченностью, обусловленной структурой кристаллической решетки, в которой атомы жестко связаны между собой и имеют ограниченное число степеней свободы. Такая структура может быть представлена малым числом микросостояний. В жидком состоянии молекулы имеют большую свободу движений относительно друг друга, что обусловливает образование значительно большего числа комбинаций взаимного расположения молекул (микросостояний). Поэтому такое состояние имеет большие значения S, чем кристаллическое состояние, т.е. 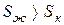 . Это приводит к положительному изменению энтропии.
. Это приводит к положительному изменению энтропии.
Пример 6. Определение знака изменения энтропии процесса на основе строения реагентов и продуктов реакции.
Задача 1. Как изменится энтропия процесса гидрирования фенола
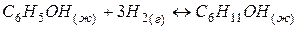
Решение. Как и в предыдущем примере  процесса определяется разностью энтропий конечного и исходного состояний
процесса определяется разностью энтропий конечного и исходного состояний
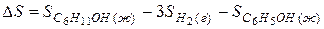 (1)
(1)
Из двух структур C6H11OH и C6H5OH первая является более высокоорганизованной, поскольку заключает в себе большее количество химических связей и большее число структурных единиц (атомов). Поэтому 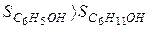 . Кроме того, второй реагент является газом, молекулы которого автономны и имеют бесчисленное множество микросостояний, поэтому
. Кроме того, второй реагент является газом, молекулы которого автономны и имеют бесчисленное множество микросостояний, поэтому 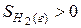 . Все это обусловливает в соответствии с (1) уменьшение энтропии при реализации процесса.
. Все это обусловливает в соответствии с (1) уменьшение энтропии при реализации процесса.
Пример 7. Выявление возможности протекания химической реакции по величине изменения энергии Гиббса.
Задача 1. В каком направлении будет протекать реакция 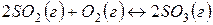 в стандартных условиях?
в стандартных условиях?
Решение. Изменение энергии Гиббса в данной реакции характеризуется равенством
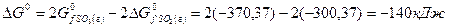
Поскольку 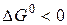 , то в стандартных условиях данная реакция может протекать в сторону образования
, то в стандартных условиях данная реакция может протекать в сторону образования  .
.
Пример 8. Вычисление изменение энергии Гиббса в химической реакции по значениям теплот образования и энтропий реагирующих веществ и продуктов реакции.
Задача 1. Вычислите изменение энергии Гиббса 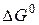 для химической реакции
для химической реакции 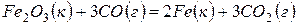 . Возможно ли протекание этой реакции в стандартных условиях?
. Возможно ли протекание этой реакции в стандартных условиях?
Решение. Воспользуемся для решения поставленных задач значениями теплот образования и энтропий реагентов и продуктов реакции:
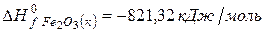
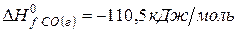
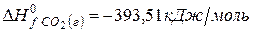
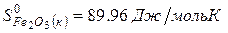
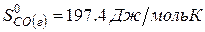
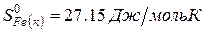
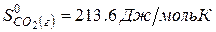
Изменение энергии Гиббса в химической реакции при температуре Т можно рассчитать по уравнению
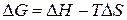 .
.
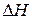 рассчитываем на основе следствия из закона Гесса (см. ур-е 7):
рассчитываем на основе следствия из закона Гесса (см. ур-е 7):
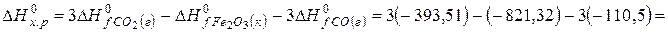
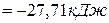 .
.
Изменение энтропии в соответствии с уравнением (6) выражается равенством:
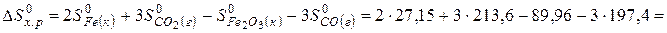
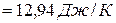 .
.
Изменение энергии Гиббса в химической реакции равно
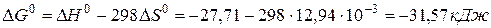
Из результатов расчета ( 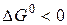 ) следует, что в стандартных условиях реакция осуществима.
) следует, что в стандартных условиях реакция осуществима.
1.5. Химическая кинетика и равновесие
Кинетика – раздел химической науки, изучающий скорости химических реакций и факторы, влияющие на скорость реакций.
Термодинамика на основе значений 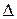 G или других критериев дает ответ на вопрос принципиальной осуществимости того или иного процесса. Но она не может ответить на вопрос, насколько быстро может быть осуществлен переход в термодинамически выгодном направлении. Если этот переход характеризуется бесконечно большим временем, то такой процесс невыгодно осуществлять в данных условиях и необходимо использовать факторы, которые бы его интенсифицировали. Например, реакция окисления водорода
G или других критериев дает ответ на вопрос принципиальной осуществимости того или иного процесса. Но она не может ответить на вопрос, насколько быстро может быть осуществлен переход в термодинамически выгодном направлении. Если этот переход характеризуется бесконечно большим временем, то такой процесс невыгодно осуществлять в данных условиях и необходимо использовать факторы, которые бы его интенсифицировали. Например, реакция окисления водорода
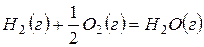
без каких-либо внешних воздействий не протекает в стандартных условиях, несмотря на его термодинамическую выгодность ( 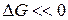 ). Внесение в такую систему катализатора, платиновой черни, приводит к мгновенному взаимодействию – взрыву. Этот результат можно проиллюстрировать нижеследующей энергетической диаграммой (рис.1).
). Внесение в такую систему катализатора, платиновой черни, приводит к мгновенному взаимодействию – взрыву. Этот результат можно проиллюстрировать нижеследующей энергетической диаграммой (рис.1).
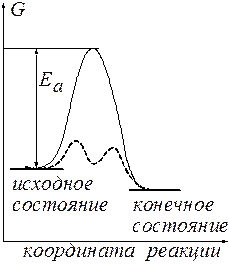
Рис.1 Энергетическая диаграмма реакции.
Можно видеть, что 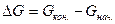 имеет отрицательное значение, обусловливающее осуществимость этого процесса. В то же время энергетический барьер ЕА, который должна преодолеть реакция, достаточно высок. Такой барьер трудно преодолеть, что и выражается в бесконечно низкой скорости реакции. Если использовать в этом процессе катализатор, то с его помощью реакция начинает протекать по новому энергетическому руслу (пунктирная линия). Можно видеть, что барьеры, которые должна преодолевать система, проходя через это русло, существенно ниже, и ее собственного энергетического запаса хватает, чтобы с лихвой их преодолеть. Это находит свое выражение в резком ускорении реакции.
имеет отрицательное значение, обусловливающее осуществимость этого процесса. В то же время энергетический барьер ЕА, который должна преодолеть реакция, достаточно высок. Такой барьер трудно преодолеть, что и выражается в бесконечно низкой скорости реакции. Если использовать в этом процессе катализатор, то с его помощью реакция начинает протекать по новому энергетическому руслу (пунктирная линия). Можно видеть, что барьеры, которые должна преодолевать система, проходя через это русло, существенно ниже, и ее собственного энергетического запаса хватает, чтобы с лихвой их преодолеть. Это находит свое выражение в резком ускорении реакции.
Уравнение скорости необратимой химической реакции
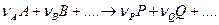
может быть выражено в следующей форме:
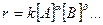 (1)
(1)
где :
k – константа скорости, определяемая как величина скорости при единичных концентрациях реагентов [А]= 1 моль/л, [В]= 1 моль/л и т.д.;
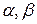 – частные порядки реакции по соответствующим реагентам А, В и др., определяющие степень влияния этих реагентов на скорость реакции;
– частные порядки реакции по соответствующим реагентам А, В и др., определяющие степень влияния этих реагентов на скорость реакции;
Сумма частных порядков реакции 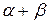 +… называется общим порядком реакции.
+… называется общим порядком реакции.
Уравнение (1) в концентрированном виде включает в себя действие различных факторов. К таким факторам относятся:
· концентрация реагентов;
· давление;
· температура;
· катализатор.
Концентрация реагентов является фактором ускорения химических реакций, поскольку, как правило, порядки реакции имеют положительное значение. Физически это легко объяснимо: с ростом концентрации возрастает количество молекул реагентов в единице объема, а следовательно, вероятность их столкновений, приводящих к химическому взаимодействию.
Давление выступает в качестве фактора ускорения процесса, когда реагент является газом. Так, если мы имеем дело с реакцией газообразных реагентов, то к каждому из них применимы газовые законы 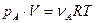 .
.
Из последнего выражения следует, что
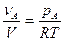 (2)
(2)
Поскольку 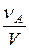 по определению концентрация реагента А, а рА по закону Дальтона линейно зависит от общего давления
по определению концентрация реагента А, а рА по закону Дальтона линейно зависит от общего давления 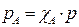 , то выражение (2) приобретает вид:
, то выражение (2) приобретает вид:
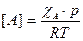 ,
,
где: 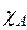 – мольная доля компонента А в газовой смеси. Значение
– мольная доля компонента А в газовой смеси. Значение 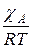 можно считать постоянной величиной и тогда
можно считать постоянной величиной и тогда
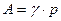 ,
,
где 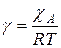 .
.
Таким образом, увеличение давления приводит к росту концентрации газообразных реагентов и в этой связи выступает как фактор скорости процесса.
Если реакционная система представляет собой систему газ – жидкость, то увеличение парциального давления газообразного реагента в соответствии с законом Генри приводит к увеличению его растворимости в жидкой реакционной массе, где, как правило, протекает реакция. Таким образом, и в этом случае давление выступает в качестве фактора увеличения концентрации реагента и, соответственно, фактора скорости процесса.
Влияние температуры на скорость реакции связано с ее влиянием на константу скорости. Основное уравнение, иллюстрирующее это влияние – уравнение Аррениуса:
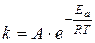 (3)
(3)
где:
А – предэкспоненциальный множитель;
ЕА – энергия активации, имеющая смысл минимального избытка энергии, которым должна обладать реагирующая частица по сравнению с их средней энергией, чтобы прореагировать.
Ускоряющее действие температуры физически обосновывается увеличением с ростом температуры доли частиц, обладающих минимальным избытком энергии ЕА, гарантирующим им преодоление энергетического барьера.
Другое, менее строгое выражение для температурного влияния на скорость химической реакции – уравнение Вант-Гоффа:
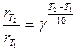 (4)
(4)
где:
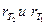 – скорости реакции при температуре Т2 и Т1 соответственно;
– скорости реакции при температуре Т2 и Т1 соответственно;
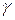 – коэффициент Вант-Гоффа, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10оС.
– коэффициент Вант-Гоффа, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10оС.
Действие катализатора как фактора ускорения процесса рассматривалось выше. Смысл ускоряющего действия катализатора – понижение энергетического барьера реакции (ЕА).
Реакции, в которых по мере накопления продуктов реакции последние вступают во взаимодействие между собой с образованием исходных реагентов, называются обратимыми.
По мере протекания этих реакций система приближается к состоянию равновесия, в котором скорости прямой и обратной реакций равны. Если на систему в состоянии равновесия не действуют какие-либо внешние факторы, то это состояние остается неизменным бесконечно долгое время и характеризуется постоянством состава реакционной массы.
Для обратимой химической реакции
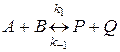
состояние равновесия определяется равенством скоростей прямой и обратной реакций
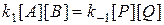
Из последнего выражения следует, что
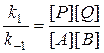 (5)
(5)
Поскольку является константой, то правая часть уравнения (5) также будет постоянной величиной, отражающей неизменность состава реакционной массы в состоянии равновесия. Величина 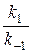 =К называется константой равновесия, характеризующей состояние системы в условиях равновесия.
=К называется константой равновесия, характеризующей состояние системы в условиях равновесия.
В стандартных условиях для обратимой реакции имеет место соотношение
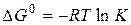 (6)
(6)
Руководствуясь этим соотношением и рисунком 1, можно показать, что катализатор, ускоряя прямую и обратную реакции, лишь ускоряет достижение равновесия, не влияя на его положение. Действительно, и в каталитической и в некаталитической реакции 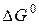 не меняется, а следовательно не меняется и К и, соответственно, состав системы в состоянии равновесия.
не меняется, а следовательно не меняется и К и, соответственно, состав системы в состоянии равновесия.
Принцип смещения равновесия (принцип Ле–Шателье) определяет направление смещения равновесия под действием различных факторов:
Если на систему, находящуюся в состоянии равновесия, оказывается внешнее воздействие, то равновесие смещается в сторону процесса, ослабляющего это воздействие.
